第三章 滴定分析法基础知识
考试大纲要求
1. 掌握滴定分析法的基本术语及条件、滴定液浓度的表示、滴定液的配制和标定方法、滴定分析的有关计算;
2. 熟悉滴定分析法的分类和滴定方式以及基准物质的条件;
3. 了解滴定分析的一般过程和滴定曲线,一般指示剂的变色原理和指示终点的原理及常用的滴定方式。
内容提要
1.滴定分析法:滴定曲线的特点和滴定突跃,选择指示剂的一般原则;
2.滴定分析法:各种滴定方式及其适用条件;
3.标准溶液和基准物质;
4.标准溶液浓度的表示方法;
5.滴定分析的有关计算;
6.标准溶液浓度的有关计算,物质的量浓度与滴定度有关计算;
7.滴定分析各个化学平衡。
【配套习题】
一、名词解释
1.化学计量点
2.滴定度
3.基准物质
4.标定
5.标准溶液
6.指示剂
7.指示剂的理论变色点
二、填空题
1.滴定分析的滴定方式包括 、 、 和 。
2. 不符合基准物质条件的试剂,可用 法来配制其标准溶液。
3. 当加入的滴定剂不能与被测物质立即定量完成的滴定反应可采用 法进行滴定。
4. 测定卤化物、硫氰酸盐、银盐等物质的含量常用 法测定;滴定多种金属离子常用 法;测定还原性或氧化性物质常用 法。
5. 滴定分析中,当加入的滴定剂的量与物质的量恰好符合化学计量关系时,称为 。
三、选择题
1.滴定分析法是( )中的一种分析方法。
A.化学分析法 B.重量分析法 C.仪器分析法 D.中和分析法
2.滴定分析法主要用于:( )
A.仪器分析 B.常量分析 C.定性分析 D.重量分析
3.对于滴定分析法,下述错误的是:( )
A.以化学反应为基础的分析方法
B.是药物分析中常用的一种含量测定方法
C.所有化学反应都可以用于滴定分析
D.要有合适的方法指示滴定终点
4. 测定CaCO3的含量时,加入一定量过量的HCl滴定液与其完全反应,剩余的HCl用NaOH溶液滴定,此滴定方式属于:( )
A.直接滴定方式 B.返滴定方式
C.置换滴定方式 D.间接滴定方式
5.下列哪项不是基准物质必须具备的条件:( )
A.物质具有足够的纯度 B.物质的组成与化学式完全符合
C.物质的性质稳定 D.物质易溶于水
6.下列可以作为基准物质的是:( )
A.NaOH B.HCl C.H2SO4 D.Na2CO3
7.下列不能用直接配制法配制滴定液的物质是:( )
A.K2Cr2O7 B.NaCl C.HCl D.AgNO3
8.用基准物质配制滴定液应选用的方法为:( )
A.多次称量配制法 B.移液管配制法
C.直接配制法 D.间接配制法
9.用基准物质配制滴定液,应选用的量器是:( )
A.容量瓶 B.量杯 C.量筒 D.滴定管
10.滴定终点是指:( )
A.滴定液和被测物质质量相等时
B.加入滴定液25.00ml时
C.滴定液与被测物质按化学反应式反应完全时
D.指示剂发生颜色变化的转变点
11.下列试剂中,可用直接法配制标准溶液的是:( )
A.K2Cr2O7 B.NaOH C.H2SO4 D.KMnO4
12.某些金属离子(如Ba2+、Sr2+、Mg2+、Ca2+、Pb2+、Cd2+等)能生成难溶的草酸盐沉淀。将草酸盐沉淀过滤出来,洗涤除去多余的C2O42-,用稀H2SO4溶解后,以KMnO4标准溶液滴定与金属离子相当的C2O42-,由此测定金属离子的含量。以上测定所采用的滴定方式是:( )
A.直接滴定 B.返滴定 C.间接滴定 D.氧化还原滴定
13.下列说法正确的是:( )
A.指示剂的变色点即为化学计量点
B.分析纯的试剂均可作基准物质
C.定量完成的反应均可作为滴定反应
D.已知准确浓度的溶液称为标准溶液
14.将Ca2+沉淀为CaC2O4,然后溶于酸,再用KMnO4标准溶液滴定生成的H2C2O4,从而测定Ca的含量。所采用的滴定方式属于:( )
A.直接滴定法 B.间接滴定法
C.沉淀滴定法 D.氧化还原滴定法
15. 用甲醛法测定铵盐中的氮含量,采用的滴定方式是:( )
A.直接滴定法 B.酸碱滴定法
C.置换滴定法 D.返滴定法
16.下列误差中,属于终点误差的是:( )
A.在终点时多加或少加半滴标准溶液而引起的误差
B.指示剂的变色点与等量点(化学计量点)不一致而引起的误差
C.由于确定终点的方法不同,使测量结果不一致而引起的误差
D.终点时由于指示剂消耗标准溶液而引起的误差
17.用高锰酸钾法测定钙,常用的滴定方式是:( )
A.返滴法 B.氧化还原滴定法
C.间接滴定法 D.直接滴定法
18.下列试剂中,可作为基准物质的是:( )
A.NaOH B.HCl C.KMnO4 D.K2Cr2O7
19.配制NaOH标准溶液,正确的方法为( )。
A.用分析天平精确称取一定质量NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需的体积,再标定
B.用分析天平精确称取一定质量优级纯NaOH于洁净的烧杯中,加蒸馏水溶解后,定容于所需体积的容量瓶中,计算出其准确浓度
C.用台称称取一定质量NaOH于洁净的烧杯中,加蒸馏水溶解后,定容于所需体积的容量瓶中,计算出其准确浓度
D.用台称称取一定质量NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需的体积,再标定
20.标准溶液是指( )的溶液。
A.由纯物质配制成 B.由基准物配制成
C.能与被测物完全反应 D.已知其准确浓度
四、综合题
1.什么是基准物质?它应具备什么条件?
2.简述标准溶液的配制方法。
3.简述滴定度的概念。
4.滴定分析对化学反应有什么要求?能用于直接配制标准溶液的物质需具备什么条件?
5.称取含铝试样0.5300g,溶解后定溶为100.0mL的溶液。精密吸取20.00ml上述溶液于锥形瓶中,准确加入EDTA(0.05012mol·L-1)标准溶液20.00ml,控制条件使Al3+与EDTA反应完全,然后用的ZnSO4(0.05035mol·L-1)标准溶液滴定剩余的EDTA,消耗ZnSO4标准溶液15.20ml,计算试样中Al2O3的含量。 (已知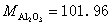 )
)
参考答案
一.名词解释
1.化学计量点:滴定剂的量与被测物质的量正好符合化学反应式所表示的计量关系的一点。
2.滴定度:每1ml某摩尔浓度的滴定液所相当的被测药物的质量(g/ml)。
3.基准物质:能用于直接配制或标定标准溶液的物质。
4.标定:通过滴定来确定试剂准确浓度的操作。
5.标准溶液:已知准确浓度的试剂溶液。
6.指示剂:能在计量点附近发生颜色变化的试剂。
7.指示剂的理论变色点:指示剂具有不同颜色的两种型体浓度相等时,即[In]=[XIn]时,溶液呈两型体的中间过渡颜色,这点为理论变色点。
二、填空题
1. 直接滴定;返滴定;间接滴定;置换滴定
2. 间接法
3.返滴定法
4. 沉淀滴定法;配位滴定法;氧化还原滴定法
5. 反应达到化学计量点
三、选择题
1.A;2.B;3.C;4.B;5.D;6.D;7.C;8.C;9.A;10.D;11.A;12.C;13.D;14.B;15.C;16.B;17. C; 18. D; 19. D; 20. D;
四、综合题
1. 答:基准物质是可用来直接配制滴定液或标定溶液浓度的物质。
对基准物质应具备的条件有:
(1)纯度要高:物质必须具有足够的纯度(99.9%)
(2)组成要固定:物质组成与化学式应完全符合;(3)性质要稳定;(4)摩尔质量(M)要较大。
2.答:方法有:1)直接法:用分析天平称量基准物质,用容量瓶配制,定容。步骤:称量→ 溶解→转移→定容→计算,根据称量的质量和体积计算标准溶液的准确浓度。公式:cV=m/M。2)间接法(标定法):标准溶液的浓度通过基准物质来确定或用另一种标准溶液来确定的方法。先配成近似浓度的溶液,再用基准物质或另一种标准溶液来确定它的准确浓度。
3.答:滴定度有两种表示方法:
1)指每毫升滴定液中所含溶质的质量(g/ml),以TB表示。mB=TB·V;
2)指每毫升滴定液相当于被测物质的质量(g/ml),以TB/A表示。mA=TB/A·V。
4.答:用于滴定分析的化学反应必须具备下列几个条件:
1)反应必须定量完全。即被测物质与标准溶液之间必须按一定的反应方程式进行,有确定的化学计量关系;无副反应发生;反应完全程度达99.9%以上;这是定量计算的依据。
2)反应必须快速。最好瞬间完成。对于速率较慢的反应,有时可通过控制适当条件(如加热、催化剂等)来提高反应速率。
3)必须有适宜方法确定终点。如指示剂,仪器分析法等。
只有基准物质才能用直接法配制成标准溶液。基准物质应具备如下条件:
(1)组成和化学式完全相同。
(2)纯度足够高(一般在99.9%以上)。
(3)性质稳定,例如不吸空气中的水分和CO2,不易被空气中的氧氧化等。
(4)按一定的反应式反应完全,不发生副反应。
(5)最好有较大的相对分子质量,可减小称量误差。
5. 解:相关化学反应为: Al+Y(定量过量) AlY
AlY
Zn+Y(剩余) ZnY
ZnY
1mol EDTA(即Y)相当于1mol的Al3+,相当于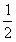 mol的Al2O3,即
mol的Al2O3,即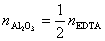 ,1mol EDTA(即Y)相当于1mol的Zn2+,即
,1mol EDTA(即Y)相当于1mol的Zn2+,即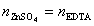
总的EDTA的物质的量:cEDTAVEDTA=0.05012×20.00(moL)
剩余的EDTA的物质的量:c ZnSO4V ZnSO4=0.05035×15.20(moL)
消耗掉的EDTA的物质的量:
cEDTAVEDTA -c ZnSO4V ZnSO4=0.05012×20.00-0.05035×15.20(moL)
试样中Al2O3的含量:
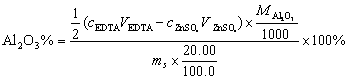
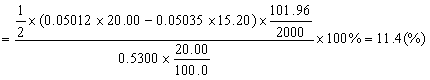
 通知公告
通知公告

 友情链接:
友情链接: