第四章 酸碱滴定法
考试大纲要求
1.掌握常用几种滴定分析方法的原理与应用范围;
2.掌握常用几种滴定分析方法的条件;
3.掌握常用几种滴定分析方法指示剂的选择;
4.了解滴定突跃与滴定突跃范围的概念;
5.熟悉条件电位、条件平衡常数、酸效应系数、最低pH、最佳酸度条件的计算。
内容提要
1.酸碱指示剂变色原理和变色范围极其影响因素,常用酸碱指示剂及混合指示剂;
2.强酸(碱)、一元弱酸(碱)、多元酸(碱)的滴定曲线特征,影响其滴定突跃范围的因素及指示剂的选择;
3.一元弱酸(碱)、多元酸(碱)准确滴定可行性的判断;
4.强酸(碱)、一元弱酸(碱)滴定终点误差的计算;
5.酸碱标准溶液的配置与标定;
6.非水溶液中酸碱滴定法基本原理:溶剂的分类,溶剂的性质(离解性、酸碱性、极性、均化效应和区分效应),溶剂的选择;
7.非水溶液中酸的滴定和碱的滴定。
【配套习题】
一、名词解释
1. 滴定突跃
2.均化效应
3.区分效应
4.质子溶剂
5.缓冲溶液
6. 混合溶剂
7.质子自递反应
8.惰性溶剂
二、填空题
1.酸碱指示剂的选择原则是 。
2.某人用HCl标准溶液来标定含CO32-的NaOH溶液(以甲基橙作指示剂),然后用NaOH溶液去测定某试样中HAc, 得到的w(HAc)将会_______。又若用以测定HCl-NH4Cl溶液中的w(HCl),其结果会_________。(填偏高、偏低或无影响)
3.用0.20 mol· L- 1NaOH溶液滴定0.10 mol· L- 1 H2SO4和0.10 mol· L- 1 H3PO4的混合溶液时
在滴定曲线上,可以出现 个突跃范围。
4.用双指示剂法(酚酞、甲基橙)测定混合碱样时,设酚酞变色时消耗HCl的体积为V1,甲基橙变色时,消耗HCl的体积为V2,则:
(1)V1>0, V2=0时,为
(2)V1=0, V2>0时,为
(3)V1= V2=0时,为
(4)V1> V2>0时,为
(5)V2> V1>0时,为
5.用NaOH滴定HAc,以下几种情况下造成的误差属于哪一类?
(1)选酚酞为指示剂滴定至pH=9.0_______
(2)选酚酞为指示剂,确定终点颜色时稍有出入_______
(3)选甲基橙为指示剂滴定至pH=4.4_______
(4)碱式滴定管中气泡未赶出_______
三、选择题
1.酸碱指示剂一般属于:( )
A.无机物 B.有机物
C.有机酸 D.有机弱酸或弱碱
2.导致酸碱指示剂发生颜色变化的外因条件是:( )
A.溶液的温度 B.溶液的湿度
C.溶液的电离度 D.溶液的酸碱度
3.标定HCl滴定液的基准物质是:( )
A.NaOH B.Na2CO3 C.HAc D.NH3H2O
4.标定NaOH溶液的基准物质是:( )
A.HAc B.Na2CO3 C.KHC8H4O4 D.NH3H2O
5.用氢氧化钠滴定液滴定HAc选择的指示剂是:( )
A.石蕊 B.甲基橙 C.酚酞 D.甲基红
6.以甲基橙为指示剂,用盐酸滴定液滴定Na2CO3,滴至溶液从黄色变到橙色,即为终点,此时HCl与Na2CO3反应的物质的量之比为:( )
A.2:1 B.1:2 C.1:1 D.3:1
7.HCl滴定液滴定NH3. H2O,应选择的指示剂是:( )
A.甲基橙 B.酚酞 C.百里酚酞 D.中性红
8.强酸强碱滴定类型,其化学计量点的酸碱性是:( )
A. pH<7 B. pH>7 C. pH = 7 D. 强酸性
9.强酸滴定弱碱,化学计量点酸碱性是:( )
A.pH<7 B.pH>7 C.pH=7 D.强酸性
10.强碱滴定弱酸,化学计量点的酸碱性是:( )
A.pH<7 B.pH>7 C.pH=7 D.强酸性
11.非水碱量法常用的溶剂是:( )
A.冰醋酸 B.无水乙醇 C.醋酐 D.稀醋酸
12.非水碱量法常用的滴定液是:( )
A.盐酸 B.高氯酸 C.醋酐 D.冰醋酸
13.OH-的共轭酸是:( )
A.H+ B.H2O C.H3O+ D.O2-
14.HPO42-的共轭碱是:( )
A.H2PO4- B.H3PO4 C.PO43- D.OH-
15. 在水溶液中共轭酸碱对Ka与Kb的关系是:( )
A.Ka·Kb=1 B.Ka·Kb=Kw C.Ka/Kb=Kw D.Kb/Ka=Kw
16.欲配制pH=5.1的缓冲溶液,最好选择:( )
A.一氯乙酸(pKa = 2.86) B.氨水(pKb = 4.74)
C.六次甲基四胺(pKb = 8.85) D.甲酸(pKa = 3.74)
四、综合题
1.某学生按如下步骤配制NaOH标准溶液,请指出其错误并加以改正。
准确称取分析纯NaOH 2.000g,溶于水中,为除去其中CO2加热煮沸,冷却后定容并保存于500mL容量瓶中备用。
2.当下列溶液各加水稀释10倍时,其pH值有何变化?计算变化前后的pH值。
(1)0.1mol/L HCl;(2)0.1mol/L NaOH;(3)0.1mol/L HAc;(4)0.1mol/L NH3H20+0.1mol/L NH4Cl
3.配制高氯酸冰醋酸溶液(0.05000mol/L)1000ml,需用70% HClO4 2 ml,所用的冰醋酸含量为99.8%,相对密度1.05,应加含量为98%,相对密度1.087的醋酐多少毫升,才能完全除去其中的水分?
参考答案
一、名词解释
1. 滴定突跃:化学计量点前后0.1% 的变化引起pH急剧变化的现象
2.均化效应:指当不同的酸或碱在同一溶剂中显示相同的酸碱强度水平。
3.区分效应:指不同的酸或碱在同一溶剂中显示不同的酸碱强度水平。
4.质子溶剂:能给出质子或接受质子的溶剂。
5.缓冲溶液:由弱酸及其共轭碱,或由弱碱及其共轭酸所组成的具有一定PH范围缓冲能力的溶液。
6. 混合溶剂:质子溶剂和惰性溶剂混合的溶剂。
7.质子自递反应:溶剂分子间产生质子相互转移的反应称为质子自递反应。
8.惰性溶剂:当溶质的酸和碱在溶剂中起反应时,溶剂分子不参与反应的溶剂称为惰性溶剂。
二、填空题
1.理论变色范围部分或全部的位于突越范围内
2.偏高;无影响
3.2
4. NaOH;NaHCO3;Na2CO3;NaOH + Na2CO3;NaHCO3 + Na2CO3
(1)V1>0, V2=0时,为
(2)V1=0, V2>0时,为
(3)V1= V2时,为
(4)V1> V2>0时,为
(5)V2> V1>0时,为
5. 系统误差;随机误差;过失;过失
三、选择题
1.D;2.D;3.B;4.D;5.D;6.C;7.A;8.C;9.A;10.B;11.A;12.B;13.B;14.C;
15.B;16.B;
四、综合题
1.答:(1)NaOH试剂中会含有水分及CO32-,其标准溶液须采用间接法配制,因此不必准确称量,亦不必定容至500mL,而是在台秤上约称取2g NaOH,最后定容亦是约500ml;
(2)加热煮沸是为除去其中CO2,然而在碱性中是以CO32-存在,加热不会除去,应当先将水煮沸冷却除去CO2后加入饱和的NaOH液(此时Na2CO3不溶于其中);
(3)碱液不能保持在容量瓶中,否则碱腐蚀,瓶塞会打不开,应置于具橡皮塞的试剂瓶中。
2.解:
(1)0.1mol/L HCl:
强酸,pH=-lg0.10=1.00 稀释后:pH=-lg0.01=2.00
(2)0.1mol/L NaOH:
强碱, pOH=-lg0.10=1.00 pH=13.00
稀释后:pOH=-lg0.01=2.00 pH=12.00
(3)0.1mol/L HAc:弱酸
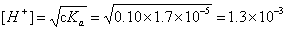 pH=2.88
pH=2.88
稀释后:
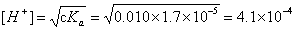 pH=3.38
pH=3.38
(4)0.1mol/L NH3H20+0.1mol/L NH4Cl:缓冲体系
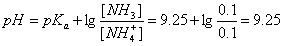
稀释后:
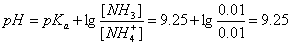
3.解:除去HClO4中的水所需酸酐:
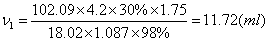
除去冰醋酸中的水所需酸酐:
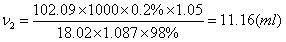
V= V1+ V2=11.72+11.16=22.88(ml)
 通知公告
通知公告

 友情链接:
友情链接: