第五章 氧化还原滴定法
考试大纲要求
1. 掌握碘量法、高锰酸钾法、亚硝酸钠法等常用氧化 还原滴定法的测定原理、条件和滴定液的配制及标定方法;
2. 熟悉氧化还原滴定法指示剂的类型、变色原理和确定滴定终点的方法;
3. 了解氧化还原滴定法的特点、分类与应用,会对氧化还原反应的完成程度作出判断。
内容提要
1. 条件电位及其影响因素;
2. 氧化还原反应进行的程度和速度;
3. 氧化还原滴定曲线;
4. 氧化还原滴定法中的曲线;
5. 常用的氧化还原滴定法:碘量法,高锰酸钾法,亚硝酸钠法等。
【配套习题】
一、名词解释
1.电极电位
2.标准电极电位
3.条件电极电位
4.可逆氧化还原电对
5.碘量法
6.自身氧化剂
二、填空题
1.标定硫代硫酸钠一般可选_______作基准物,标定高锰酸钾溶液一般选用_______作基准物。
2.氧化还原滴定中,采用的指示剂类型有_______、______、______、______和_______。
3.高锰酸钾标准溶液应采用_______方法配制,重铬酸钾标准溶液采用_______方法配制。
4.碘量法中使用的指示剂为_______,高锰酸钾法中采用的指示剂一般为_______。
5.氧化还原反应是基于_______转移的反应,比较复杂,反应常是分步进行,需要一定时间才能完成。因此,氧化还原滴定时,要注意_______速度与_______速度相适应。
6.标定硫代硫酸钠常用的基准物为_______,基准物先与_______试剂反应生成_______,再用硫代硫酸钠滴定。
7.碘在水中的溶解度小,挥发性强,所以配制碘标准溶液时,将一定量的碘溶于_______溶液。
8.氧化还原指示剂的变色范围为 ,选择指示剂的原则是 。
三、选择题
1. 标定KMnO4滴定液时,常用的基准物质是: ( )
A.K2Cr2O7 B.Na2C2O4 C.Na2S2O3 D.KIO3
2. 在酸性介质中,用KMnO4溶液滴定草酸盐溶液时,滴定应: ( )
A.在开始时缓慢,以后逐步加快,近终点时又减慢滴定速度
B.像酸碱滴定一样快速进行
C.始终缓慢进行
D.开始时快,然后减慢
3. 在间接碘量法中,加入淀粉指示剂的适宜时间是: ( )
A.滴定开始时 B.滴定近终点时
C.滴入滴定液近30%时 D.滴入滴定液近50%时
4.氧化还原滴定的主要依据是:( )
A.滴定过程中氢离子浓度发生变化
B.滴定过程中金属离子浓度发生变化
C.滴定过程中电极电位发生变化
D. 滴定过程中有络合物生成
5. 下列物质中,可以用氧化还原滴定法测定的是: ( )
A.草酸 B.醋酸 C.盐酸 D.硫酸
6. 直接碘量法应控制的条件是: ( )
A.强酸性条件 B.强碱性条件
C.中性或弱酸性条件 D.什么条件都可以
7. 下列有关淀粉指示剂的应用不正确的是: ( )
A.配制指示剂以选用直链淀粉为好
B.为了使终点颜色变化明显,溶液要加热
C.可加入少量碘化汞,使淀粉溶液保存较长时间
D.在间接碘量法中,淀粉必须在近终点时加入
8. 碘量法中使用碘量瓶的目的是: ( )
A.防止碘的挥发 B.防止溶液与空气接触
C.防止溶液溅出 D.A+B
9.KMnO4在强碱溶液中的还原产物是: ( )
A. MnO2 B. MnO42- C.MnO4- D.Mn2+
10.KMnO4法滴定溶液的常用酸度条件是: ( )
A. 强碱 B. 弱碱 C. 强酸 D. 弱酸
11.下列有关氧化还原反应的叙述,哪个是不正确的: ( )
A.反应物之间有电子转移
B. 反应物中的原子或离子有氧化数的变化
C. 反应物和生成物的反应系数一定要相等
D.电子转移的方向由电极电位的高低来决定
12. 在用重铬酸钾标定硫代硫酸钠时,由于KI与重铬酸钾反应较慢,为了使反应能进行完全,下列哪种措施是不正确的( )
A.增加 KI的量 B. 适当增加酸度 C. 使反应在较浓溶液中进行 D. 加热
13.下列哪些物质可以用直接法配制标准溶液: ( )
A.重铬酸钾 B. 高锰酸钾 C.碘 D. 硫代硫酸钠
14.下列哪种溶液在读取滴定管读数时,读液面周边的最高点: ( )
A.NaOH标准溶液 B.硫代硫酸钠标准溶液
C.碘标准溶液 D.高锰酸钾标准溶液
15.配制I2 标准溶液时,正确的是: ( )
A. 碘溶于浓碘化钾溶液中 B. 碘直接溶于蒸馏水中
C. 碘溶解于水后,加碘化钾 D. 碘能溶于酸性中
16.间接碘量法对植物油中碘价进行测定时,指示剂淀粉溶液应( )。
A. 滴定开始前加入 B. 滴定一半时加入
C. 滴定近终点时加入 D. 滴定终点加入
17. 提高氧化还原反应的速度可采取( )措施 。
A. 增加温度 B. 加入络合剂 C. 加入指示剂 D. 减少反应物浓度
18.下列说法正确的是: ( )
A. 平衡常数大的氧化还原反应能用于滴定分析
B. 讨论氧化还原反应能否进行时,不仅要从热力学角度考虑反应可行性,还应从动力学角度考虑反应进行的现实性
C. 在滴定分析中都可以利用加热的办法来加速反应的进行
D. 在氧化还原滴定分析中,化学计量点电势φsp位于滴定突跃的中点
19. 氧化还原滴定曲线是( )变化曲线。
A. 溶液中金属离子浓度与pH关系 B. 氧化还原电极电位与滴定剂用量关系
C. 溶液 pH 与金属离子浓度关系 D. 溶液pH与滴定剂用量关系
20. 电极电位对判断氧化还原反应的性质很有用,但它不能判断: ( )
A. 氧化还原反应的完全程度 B. 氧化还原反应速率
C. 氧化还原反应的方向 D. 氧化还原能力的大小
四、判断题
1.KMnO4溶液作为滴定剂时,必须装在棕色酸式滴定管中。( )
2.直接碘量法的终点是从蓝色变为无色。( )
3.用基准试剂草酸钠标定KMnO4溶液时,需将溶液加热至 75~85℃进行滴定,若超过此温度,会使测定结果偏低。( )
4.溶液的酸度越高,KMnO4氧化草酸钠的反应进行得越完全,所以用基准草酸钠标定 KMnO4溶液时,溶液的酸度越高越好。( )
5.硫代硫酸钠标准滴定溶液滴定碘时,应在中性或弱酸性介质中进行。( )
6.用间接碘量法测定试样时,最好在碘量瓶中进行,并应避免阳光照射,为减少与空气接触,滴定时不宜过度摇动。( )
7.用于重铬酸钾法中的酸性介质只能是硫酸,而不能用盐酸。( )
8.重铬酸钾法要求在酸性溶液中进行。( )
9.碘量法要求在碱性溶液中进行。( )
10.在碘量法中使用碘量瓶可以防止碘的挥发。( )
五 综合题
1. 碘量法的主要误差来源有哪些?如何消除?
2.氧化还原滴定的主要依据是什么?它与酸碱滴定法有什么相似点和不同点?
3.氧化还原性指示剂的变色原理和选择原则与酸碱指示剂有何异同?
4. 为了用KIO3作基准物标定Na2S2O3溶液,称取0.1500 g KIO3与过量KI作用。析出的碘用Na2S2O3溶液滴定,用去24.00 mL。此Na2S2O3溶液的浓度为多少?(提示: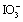 + 5 I- + 6 H+ = 3 I2 + 3 H2O)
+ 5 I- + 6 H+ = 3 I2 + 3 H2O)
参考答案
一、名词解释
1.电极电位: 金属浸于电解质溶液中,金属的表面与溶液间产生电位差,这种电位差称为金属在此溶液中的电位或电极电位。
2.标准电极电位:标准状态下,测得的氧化还原电对的电极电位。
3.条件电极电位:在一定介质条件下,氧化态与还原态浓度比为1时,校正外界因素影响后的实际电极电位。
4.可逆氧化还原电对: 在氧化还原反应的任一瞬间能迅速建立平衡,其实际电势与Nernst公式计算值基本相符的电对称之可逆电对。
5.碘量法:以I2为氧化剂或以KI为还原剂进行滴定的分析方法称为碘量法。
6.自身指示剂:在氧化还原滴定中,滴定液或待测组分自身氧化态与还原态颜色明显不同,可以利用其两种颜色的变化指示滴定终点,这类指示剂称为自身指示剂。
二、填空题
1.重铬酸钾;草酸钠
2.自身指示剂;特殊指示剂;外用指示剂;不可逆指示剂;氧化还原指示剂 ;
3.间接法;直接法;
4.特殊指示剂(淀粉指示剂);自身指示剂 ;
5.电子;滴定;化学反应;
6.重铬酸钾;碘化钾;碘;
7.碘化钾 ;
8.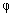 =
=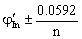 ; 指示剂的条件电势与化学计量点电势接近;
; 指示剂的条件电势与化学计量点电势接近;
三、选择题
1.B;2.A;3.B;4.C;5.A;6.C;7.B;8.D;9.D;10.C;11.C;12.D;13.A;14.C;15.A;16.A;17.A;18.B;19.B;20.B;
四、判断题
1. √;2.×;3.×;4.×;5.√;6.√;7.×;8.√;9.×;10.√
五、综合题
1.答:I2容易挥发和I-易被空气氧化,它们是碘量法的两个主要的误差来源。
(1)为防止碘的挥发,应采取以下措施:
①应加入过量的KI使其形成I3-络离子(同时增大I2在水中的溶解度);
②反应温度不宜过高,一般应在室温下进行;
③析出碘的反应最好在带塞子的碘量瓶中进行;
④反应完全后立即滴定,且勿剧烈摇动。
(2)为防止I-的氧化应注意: 一般反应后应立即滴定,且滴定在中性或弱酸性介质中进行。
2.答:氧化还原滴定的主要依据是氧化还原滴定过程中体系中电势的变化在化学计量点附近有一个突跃,以此来判断反应终点。
与酸碱滴定法相似点是化学计量点附近都存在滴定突跃。
不同点是酸碱滴定法变化的是溶液中pH值,氧化还原滴定中变化的量是电极电势;酸碱滴定法中影响滴定突跃的因素是酸碱强度和浓度,而在对称的氧化还原滴定中影响滴定突跃的因素是条件电势和反应中的电子转移数。
3.答:氧化还原性指示剂是本身具有氧化还原性质的有机化合物,其氧化形式和还原形式有不同颜色,因在滴定突跃时发生氧化还原作用而发生颜色变化来指示反应的终点。在选择指示剂时,应使指示剂的条件电势尽量与化学计量点时电势接近,以减少终点误差。酸碱指示剂本身是有机弱酸或弱碱,当溶液pH值改变时,由于结构改变而发生颜色改变。选择指示剂时,指示剂的变色范围应处于或部分处于滴定突跃范围内。
4.解:已知两个反应为 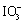 + 5 I- + 6 H+ = 3 I2 + 3 H2O
+ 5 I- + 6 H+ = 3 I2 + 3 H2O
I2 + 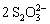 =
= 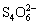 + 2I-
+ 2I-
基准物与被测物物质的量之间的关系为
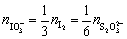
根据题意 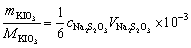
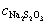 =
= 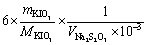
= 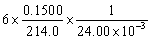
= 0.1752 mol·L-1
 通知公告
通知公告

 友情链接:
友情链接: