第六章 配位滴定法
第一节 配位滴定法概述
掌握:EDTA的性质、配位滴定条件的选择和控制、配合物的条件稳定常数。
熟悉:配位滴定中的酸效应、配位滴定准确性的判断。
了解:配位滴定法的应用。
一、 配位滴定的概念及条件
配位滴定法是以形成配位化合物反应为基础的滴定分析方法。常用的配位滴定是EDTA滴定。
二、 EDTA的结构、性质及在水中的电离平衡
(一)EDTA的结构与性质
EDTA全称为乙二胺四乙酸,常用H4Y表示,其结构式为
HOOCCH2 CH2COOH



 N-CH2- CH2-N
N-CH2- CH2-N
HOOCCH2 CH2COOH
(二)EDTA在水中的电离平衡
EDTA相当于六元酸,在溶液中有六级离解平衡,EDTA相当于六元酸,在溶液中有六级离解平衡当pH>10.26时 ,主要以Y4-型体存在。只有Y4-可直接与金属离子配合,故EDTA在碱性溶液中配位能力较强。
三、 EDTA与金属离子配位反应的特点
EDTA与金属离子能形成螯合物,配位比为1:1。
第二节 配位滴定基本原理
一、 EDTA配合物的稳定常数
金属离子与EDTA的反应通式为:
M + Y = MY KMY = 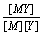 …… 稳定常数
…… 稳定常数
金属与EDTA配合物的lgK稳值见表6-1。
二、 副反应和副反应系数
主反应 M + Y = MY











 L OH H N H OH
L OH H N H OH
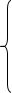 ML MOH HY NY MHY M(OH)Y
ML MOH HY NY MHY M(OH)Y
副反应 ML2 M(OH)2 H2Y
┊ ┊ ┊
MLn M(OH)n H6Y
配位效应 酸效应 共存离子效应
1、酸效应及酸效应系数
在水溶液中,EDTA有H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-和Y4-等七种存在型体,真正能与金属离子配位的是Y4-离子。设[Y]为Y4-的浓度,[Y¢]为未与M配位的EDTA各种存在型体的总浓度:
a Y(H) = [Y¢] / [Y]
= 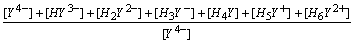
= 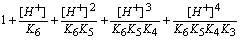
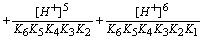
a Y(H)为配位剂与H+的副反应系数,由于a Y(H)是 [H+]的函数,故又称为酸效应系数。
不同pH下,lga Y(H) 见表6-2。
结论:① pH ¯ Þ aY(H) ,副反应越严重。
② 当pH≥12时,[Y]≈[Y¢],aY(H)≈1,几乎无副反应发生。
2、金属离子的配位效应及配位效应系数
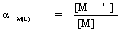 配位效应:由于其它配位剂的存在使金属离子与EDTA配合能力降低的现象。
配位效应:由于其它配位剂的存在使金属离子与EDTA配合能力降低的现象。
αM(L) 越大,配位剂所引起副反应就越严重
当配位剂L浓度越大,αM(L)值越大
3. 条件稳定常数
在没有副反应发生时,M与Y反应进行程度可用稳定常数KMY表示,KMY值越大,配合物越稳定。但实际上由于副反应的存在,KMY值已不能反映主反应进行的程度,因此,引入条件稳定常数表示有副反应发生时主反应进行的程度。
KMY = 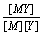 …… 稳定常数 K¢MY =
…… 稳定常数 K¢MY = 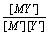 …… 条件稳定常数
…… 条件稳定常数
K¢MY = 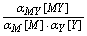 = KMY
= KMY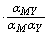 lg K¢MY = lg KMY -lg aM - lg aY + lg aMY
lg K¢MY = lg KMY -lg aM - lg aY + lg aMY
在一定条件下,aM、aY 和aMY均为定值,因此K¢MY是个常数,它是用副反应系数校正后的实际稳定常数。因aMY在多数计算中可忽略不计,则
lg K¢MY = lg KMY -lg aM - lg aY
如体系无其他配位剂或其他配位剂产生的影响较小时,可忽略其他配位剂的影响,则
lg K¢MY = lg KMY - lg aY
例:计算pH=11,[NH3] = 0.1mol/L时的lg K¢ZnY
解:查表,lg KZnY=16.50 (P.92) lgb1~b4分别为2.27,4.61,7.01,9.06(P.175)
pH=11时,lg aY(H)=0.07 (P.95) lg aZn(OH)=5.4 (P.177)
aZn(NH3) = 1 + b1 [NH3] + b2 [NH3]2 + b3 [NH3]3 + b4 [NH3]4
= 1 + 102.27´ 0.1 + …109.06´ 0.14 = 105.10
aZn = aZn(NH3) + aZn(OH) -1 » 105.6 lg aZn = 5.6
lg K¢ZnY = lg KZnY -lg aZn - lg aY = 16.50 - 5.6 - 0.07 = 10.83
三、 配位滴定条件的选择
配位滴定曲线
设以浓度为CY的EDTA 滴定浓度为CM、体积为VM的金属离子M,在滴定的任一阶段(加入EDTA的体积为VY时),[M¢]可由以下方程解得:
 [M¢] + [MY¢] =
[M¢] + [MY¢] = 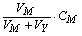
[Y¢] + [MY¢] = 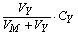
K¢MY = 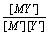 由[M¢]计算pM¢,即可绘制滴定曲线。
由[M¢]计算pM¢,即可绘制滴定曲线。
结论:CM ,K¢MY Þ 滴定突跃范围
(一)酸度的选择
1、最高酸度 (最低pH值)
当溶液酸度达到某一限度时,因酸效应影响,使lg <8,不能满足准确滴定的条件,此时,就不能准确滴定。该值就称最高允许酸度 (又称最低pH)。
2、最低酸度 (最高pH值)
最低酸度:金属离子开始水解刚好生成M(OH)n时的pH可用M(OH)n的溶度积Ksp求出 。
3、最适宜(最佳)酸度条件
最低pH < 最佳酸度 < 最高pH
(二)掩蔽及解蔽作用
掩蔽剂:为消除封闭现象,加入某种试剂使封闭离子不能与指示剂配位以消除干扰,这种试剂称为掩蔽剂。例如测定水中Ca, Mg含量,Fe3+, Al3+封闭铬黑T,可加三乙醇胺作掩蔽剂。
解蔽:加入另一种试剂将已被掩蔽的干扰离子N释放出来的方法。
第三节 金属指示剂
一、 金属指示剂的作用原理及条件
1. 金属指示剂的作用原理
例:铬黑T 终点前: Mg + In =MgIn(红) Mg + Y = MgY
(EBT) 终点时: MgIn + Y = MgY + In (蓝)
2、金属指示剂应具备的条件
金属指示剂应具备的条件:① MIn 与In 的颜色有明显区别
② K¢MY > K¢MIn,一般要求 K¢MY/K¢MIn > 102
指示剂的封闭现象:K¢MY < K¢MIn ,使指示剂在化学计量点附近不能变色,或变色不敏锐。例如Fe3+、Al3+、Cu2+、Co2+、Ni2+等对铬黑T有封闭作用。
3、金属指示剂封闭、僵化、变质现象
二、 常用的金属指示剂
铬黑T(pH=7~10)、二甲酚橙(pH<6, Al3+封闭,采用返滴定法测Al3+)、PAN、钙指示剂等。
第四节 滴定液的配制与标定和配位滴定法的应用
一、 滴定液的配制与标定
(一)EDTA滴定液的配制与标定
EDTA标准溶液 ¾¾ 以基准物ZnO或金属Zn标定、铬黑T指示剂,pH=10
终点:紫红®纯蓝。
(二)ZnSO4滴定液的配制与标定
锌标准溶液 ¾¾ 以EDTA标准溶液标定、铬黑T指示剂。
二、 配位滴定法的应用
1、直接滴定法
例:测钙镁含量
Ca2+、Mg2+ ® 测总量:pH=10,以EDTA标准溶液滴定、铬黑T指示剂。
¯
测钙含量:pH>12(沉淀掩蔽Mg2+),以EDTA标准溶液滴定、钙指示剂。
2、返滴定法
例:测铝含量
加入过量EDTA标准溶液,煮沸,以Zn2+标准溶液返滴定乘余的EDTA,二甲酚橙指示剂,终点:黄®紫红(橙黄)。
 通知公告
通知公告

 友情链接:
友情链接: