第五章 氧化还原滴定法
第一节 氧化还原滴定法的基本原理
掌握 碘量法、高锰酸钾法、亚硝酸钠法的测定原理、条件和滴定液的配制及标定方法。
熟悉 氧化还原滴定法指示剂的类型、变色原理和确定滴定终点的方法。
了解 氧化还原滴定法的特点、分类与应用。
氧化还原滴定法是以氧化还原反应为基础的一种滴定方法。氧化还原反应是一种电子由还原剂转移到氧化剂的反应。
特点:① 应用范围广 :直接测Ox、Red,间接测能与Ox、Red发生定量反应的物质。
② 反应速度慢,常伴有副反应,滴定条件要求严格。
一、 氧化还原滴定法的分类
按氧化剂分类,如碘量法、溴量法、铈量法、高锰酸钾法等。
二、 氧化还原反应进行的程度
物质的氧化还原能力可以用有关电对的电极电位来表征,电对的电极电位越高,其氧化型的氧化能力越强,电对的电极电位越低,其还原型的还原能力越强。
(一)条件电位及其影响因素
1、条件电位
每一种元素的氧化形Ox和还原形Red组成一个氧化还原电对,电对的半电池反应表示为:
Ox + ne = Red
用Nernst活度式求电对的电极电位:
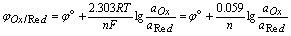 (25℃)
(25℃)
其中, 为标准电极电位,aOx和aRed分别为氧化形和还原形的活度。
为标准电极电位,aOx和aRed分别为氧化形和还原形的活度。
规定:离子或分子的活度以mol/L为单位,气体的活度以大气压为单位,纯固体、水的活度为1,除氧化形和还原形外的其它组分的活度也要包括到Nernst方程式中。
例: AgCl + e = Ag + Cl-
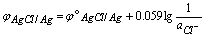
MnO4- + 8H+ + 5e = Mn2+ + 4H2O

2H+ + 2e = H2

用Nernst活度式讨论、分析问题并不方便,而通常容易知道的是反应物的浓度并非活度,Nernst浓度式为:
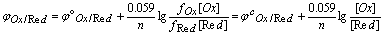
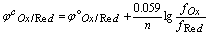 ,
,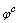 称为浓度标准电位,f为活度系数。
称为浓度标准电位,f为活度系数。
由于离子活度系数不易获得,故Nernst浓度式的实用意义不大。
一般容易知道氧化形和还原形的分析浓度,Nernst分析浓度式为:
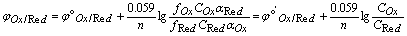
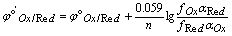 ,
, 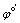 称为条件电位。
称为条件电位。
条件电位与具体实验条件(溶液离子强度,电对氧化形和还原形参与副反应等)有关。
2、影响条件电位的因素
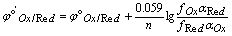
(1)盐效应
盐效应是指溶液中电解质浓度即离子强度对条件电位的影响作用。由于盐效应不易计算,氧化还原滴定体系的反应电对常常参与各种副反应,一般副反应对条件电位的影响比盐效应大,因此在估算条件电位时可忽略盐效应的影响,即假定离子的活度系数f =1,得到Nernst方程的近似表达式:
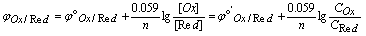
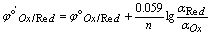
(2)生成沉淀
Ox生成沉淀, 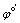 ¯;Red生成沉淀,
¯;Red生成沉淀,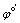
(3)生成配合物
Ox配合物稳定性高,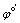 ¯;Red配合物稳定性高,
¯;Red配合物稳定性高,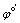
(4) 酸效应
(二)氧化还原反应进行的程度
1、氧化还原反应的平衡常数
用反应平衡常数衡量反应进行的程度
p2 Ox1 + p1 Red2 =p2 Red1 + p1 Ox2
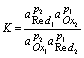
有关电对的反应为:
Ox1 + n1e = Red1 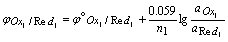
Ox2 + n2e = Red2 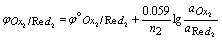
当反应达到平衡时,两电对的电极电位相等,即
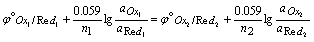
等式两边同乘以n1和n2的最小公倍数n (n= n1×p2= n2×p1),整理得,
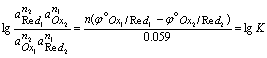
可见,氧化还原反应的平衡常数与两电对的标准电极电位及电子转移数有关。
若考虑溶液中各种副反应的影响,以相应的条件电极电位代替标准电极电位,所得平衡常数为条件平衡常数K¢,即以反应物分析浓度表示的平衡常数。
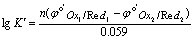
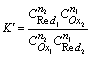
其中n为氧化还原反应得失电子总数,例如反应Cr2O72- + 6I- +14H+ = 2Cr3+ + 3I2 + 7H2O,n=6。
结论: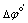 Þ K¢ , 反应进行越完全。
Þ K¢ , 反应进行越完全。
讨论:对于反应 Ox1 + Red2 = Red1 + Ox2
要使化学计量点时反应的完全程度在99.9%以上,问lgK至少应为多少,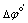 至少应为多少?
至少应为多少?
解:要使反应完全程度在99.9%以上,即要求:
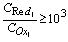
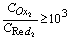
即 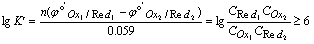
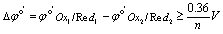
若n1=n2 =1,  ; n1=n2 =2,
; n1=n2 =2, 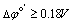 。
。
通常,若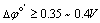 ;反应的完全程度即能满足定量分析的要求。
;反应的完全程度即能满足定量分析的要求。
三、 氧化还原反应进行的速率
氧化还原反应常常并不是一步完成,而是经历一系列的中间步骤完成的,其中有快有慢,整个反应的速度由其中最慢的步骤决定。
有的反应虽从理论上是可以进行的(K很大),但由于反应速度太慢而被认为并无反应发生。因此,对于氧化还原反应,不仅要从平衡常数来考虑反应的可能性,还要从其反应速度来考虑反应的现实性。
影响氧化还原反应速度的因素:
(1)反应物的浓度
(2)溶液的温度
(3)催化剂的作用
四、 氧化还原反应滴定曲线与指示剂
(一)滴定曲线
曲线多是通过实验测得,对于简单体系,条件电位已知,可利用电对Nernst方程式计算滴定曲线。
例:在1mol/L硫酸溶液中,以0.1000mol/L Ce(SO4)2标准溶液滴定20.00ml 0.1000mol/L FeSO4溶液。
Ce4+ + e =Ce3+ 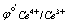 = 1.44V
= 1.44V
Fe3+ + e =Fe2+ 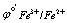 = 0.68V
= 0.68V
Ce4+ + Fe2+=Ce3+ + Fe3+ 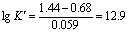
在滴定的任一时刻,反应达到平衡后,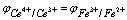
(1)滴定开始前
Fe2+(大量), Fe2+ + O2 (介质)® Fe3+ (少量) 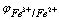 无法计算。
无法计算。
(2)化学计量点前0.1%
加入99.9%的滴定剂Ce4+,有99.9%的Fe2+被氧化成Fe3+ ,即
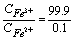
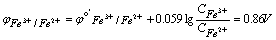
(3)化学计量点
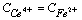
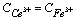
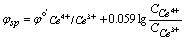

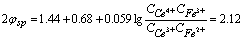
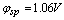
(4)化学计量点后0.1%
有0.1%过量的Ce4+加入, 即 
根据计算数据绘制滴定曲线,突跃范围为0.86~1.26V
结论:(1)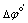 Þ 突跃范围
Þ 突跃范围
(2)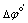 > 0.3~0.4V,可用指示剂确定终点;
> 0.3~0.4V,可用指示剂确定终点;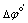 =0.2~0.3V,可用电位法确定终点;
=0.2~0.3V,可用电位法确定终点;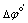 < 0.2V,无明显电位突跃。
< 0.2V,无明显电位突跃。
对于氧化还原反应 p2 Ox1 + p1 Red2 = p2 Red1 + p1 Ox2
对应的两个半反应 Ox1 + n1e = Red1 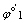
Ox2 + n2e = Red2 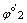
化学计量点电位的计算式 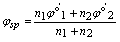 (适用于对称电对)
(适用于对称电对)
所谓对称电对即氧化形和还原形的系数相同,例如:
氧化还原反应 Cr2O72- + 6I- +14H+ = 2Cr3+ + 3I2 + 7H2O
对应的两个半反应 Cr2O72- +14H+ +6e = 2Cr3+ + 7H2O I2 + 2e = 2I-
因氧化形和还原形的系数不同,故为不对称电对,不能用上式计算化学计量点电位。
滴定突跃范围 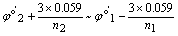
n1¹ n2时,滴定曲线在化学计量点前后是不对称的,化学计量点的电位偏向转移电子数较多的电对一方。
(二)指示剂
指示氧化还原滴定终点的常用指示剂有以下三种:
1. 自身指示剂
无需另外加指示剂 如:MnO4- ® Mn2+ I3- ® I-
紫红 无色 深棕色 无色
2. 特殊指示剂
如:淀粉溶液遇I3-生成深蓝色的吸附化合物
3.外指示剂
4.不可逆指示剂
某些指示剂在过量的氧化剂存在时会发生不可逆的颜色变化来指示滴定终点。
5.氧化还原指示剂
本身是一种弱氧化剂或弱还原剂,其氧化形或还原形具有不同的颜色。
如:InOx + ne = InRed 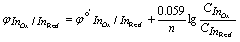
变色范围 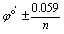 指示剂的变色范围在滴定的突跃范围内
指示剂的变色范围在滴定的突跃范围内
第二节 碘量法
一、 基本原理
I2 + 2e = 2I- 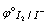 = 0.5345V (I2为较弱的氧化剂,I- 为中等强度的还原剂)
= 0.5345V (I2为较弱的氧化剂,I- 为中等强度的还原剂)
碘量法是以I2作氧化剂或以I-作还原剂进行氧化还原滴定的方法。
1. 直接碘量法 (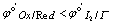 )
)
用I2标准溶液直接滴定Red,反应只能在酸性、中性或弱碱性溶液中进行
pH > 9时 I2 + 2OH- = I- + IO- + H2O 3IO- = IO3- + 2I-
3I2 + 6OH- = 5I- + IO3- + 3H2O (歧化反应)
2. 间接碘量法
 置换碘量法 (
置换碘量法 (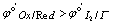 ):Ox将I-氧化成I2,用Na2S2O3标准溶 液滴定生成的I2
):Ox将I-氧化成I2,用Na2S2O3标准溶 液滴定生成的I2
剩余碘量法 (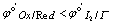 ):Red与过量的I2标准溶液反应,再用Na2S2O3标准溶液滴定剩余的I2
):Red与过量的I2标准溶液反应,再用Na2S2O3标准溶液滴定剩余的I2
I2 + 2S2O32- = 2I- + S4O62- 反应只能在中性或弱酸性溶液中进行
碱性下 4I2 + S2O32- + 10OH- = 8I- + 2SO42- + 5H2O
I2 歧化生成的IO-和IO3-将部分地氧化S2O32-为SO42-
强酸性下 S2O32- + 2H+ = S ¯ + SO2 + H2O
二、 指示剂
常用淀粉指示剂,淀粉溶液遇I2显深蓝色,反应可逆并极灵敏。
淀粉指示剂应在室温、弱酸性溶液中使用,新鲜配制。

 加入时刻: 直接碘量法 于滴定前加入
加入时刻: 直接碘量法 于滴定前加入
 间接碘量法 临近终点时加入
间接碘量法 临近终点时加入
三、 滴定液的配制与标定
(一)Na2S2O3滴定液的配制与标定
配制:Na2S2O3溶液不稳定
· 水中溶解的CO2使其分解 S2O32-+CO2+H2O = HSO3-+ HCO3- +S¯
· 空气的氧化作用 2S2O32-+O2 = 2SO42-+ 2S¯
· 水中微生物的作用 Na2S2O3 ® Na2SO3 + S¯
用刚煮沸放冷的蒸馏水配制,加少量Na2CO3,使溶液的pH=9~10,于棕色瓶中放置7~10天后标定。
标定:用K2Cr2O7、KIO3等基准物标定
Cr2O72- + 6I- +14H+ = 2Cr3+ + 3I2 + 7H2O
I2 + 2S2O32- = 2I- + S4O62-
(二)I2滴定液的配制与标定
配制:由于I2的挥发性和对天平的腐蚀性,通常用间接法配制标准溶液。将I2溶于KI的浓溶液中,再稀释至一定体积。I2溶液应贮于棕色瓶中,密塞存放。再用Na2S2O3标准溶液标定。
四、 应用示例
1. 直接碘量法
测定硫化物、亚硫酸盐、亚砷酸盐、维生素C等强还原剂。
例:维生素C的测定
加入HAc使溶液保持弱酸性,以减少维生素C与其他氧化剂的作用。
终点:无色®蓝色
2. 间接碘量法
1) 剩余碘量法
与过量I2溶液发生定量反应的物质。通常作空白滴定,以消除试剂误差。
例:葡萄糖的测定
终点:蓝色®无色
A ~ nI2 ~ 2n S2O32- 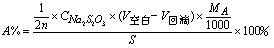
2) 置换碘量法
测定KMnO4、K2Cr2O7、KIO4等强氧化剂,CuSO4等。
例:CuSO4的测定
Cu2+ + 4I- = 2CuI ¯ + I2
用醋酸控制溶液的弱酸性,CuI沉淀能吸附I2,使终点提前,滴定时应充分振摇。
终点:蓝色®浅粉色
第三节 高锰酸钾法
一、 基本原理
MnO4- + 8H+ +5e = Mn2+ + 4H2O 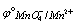 = 1.51V
= 1.51V
调节酸度用H2SO4,HNO3有氧化性,HCl有还原性,均不易使用。
标定:用Na2C2O4、H2C2O4×2H2O等基准物标定。
2 MnO4- + 5 C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
滴定开始时反应速度较慢,待有少量Mn2+生成后,由于Mn2+起自身催化作用,反应速度加快。
应用:间接法测定Ca2+
Ca2++C2O42- CaC2O4↓ CaC2O4+H+ C2O42-
5C2O42-+2MnO4-+16H+ = 2Mn2++10CO2+8H2O
第四节 亚硝酸钠法
一、基本原理
亚硝酸钠法是以亚硝酸钠为标准溶液的氧化还原滴定法。其中以应用亚硝酸钠液滴定芳伯胺类化合物的方法称为重氮法滴定法。应用亚硝酸钠液滴定芳仲胺类化合物的方法称为亚硝基化滴定法。
1.酸的种类和浓度
酸的种类和浓度:HBr中最快,HCl中次之,H2SO4HNO3中最慢。通常用1mol/L的HCl。
2.滴定速度与温度定速度与温度:一般在15℃以下。
3. 取代基团的影响
苯环上取代基团的影响:吸电子基团取代使反应加速,斥电子基团取代使反应减慢。加入适量的KBr,加快重氮化反应速度。
二、指示终点的方法
1. 外指示剂 外指示剂多用含锌碘化钾-淀粉指示液,终点时显蓝色。
2.内指示剂 内指示剂多用中性红、二苯胺等,现在多用永停滴定法确定终点。
三、滴定液的配制与标定
亚硝酸钠标准溶液常用间接法配制,可加少许碳酸钠作为稳定剂。
基准物质常用对氨基苯磺酸。
亚硝酸钠标准溶液遇光易分解,应贮存于带玻璃塞的棕色试剂瓶中,密闭保存。
重氮法滴定法主要用于测定芳伯胺类化合物,亚硝基化滴定法芳仲胺类药物。
 通知公告
通知公告

 友情链接:
友情链接: