第八章 电位法和永停滴定法
第一节 电化学分析法概述
掌握:指示电极、参比电极的概念
直接电位法测定溶液pH的原理和方法
电化学分析法的概述
熟悉:电位滴定法的原理、特点
了解:电位滴定法确定终点的方法
一、 电化学分析法的分类
 电位法:直接电位法,电位滴定法
电位法:直接电位法,电位滴定法
电化学分析法 电解法:有电解反应
电导法:根据溶液的电导性质设计
伏安法:与电流有关 永停滴定法
二、 指示电极与参比电极
化学电池
由阳极和阴极,插入电解质溶液组成。
(1)电池组成
电解池—电能转变为化学能的装置。需外加电压,才能有电极反应。
原电池—化学能转变为电能的装置。电极反应自发进行。
以铜-锌原电池(Daniell电池)为例:
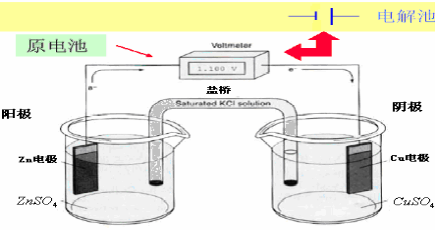
盐桥是由饱和KCl组成,用于降低或消除液接电位。
φ Cu2+¤ Cu >φ
Cu2+¤ Cu >φ Zn2+¤ Zn 原电池,自发发生电极反应
Zn2+¤ Zn 原电池,自发发生电极反应
正极: Cu2++2e Cu (还原反应、阴极)
Cu (还原反应、阴极)
负极: Zn-2e Zn 2+(氧化反应、阳极)
Zn 2+(氧化反应、阳极)
电池反应:Zn + Cu 2+ Cu + Zn 2+
Cu + Zn 2+
Daniell原电池图解表达式为:
(-) Zn│ZnSO4(1mol/L)┊┊ CuSO4(1mol/L)│Cu (+)
电池电动势:
E= φ(+) - φ(-) = φ Cu2+¤ Cu - φ
Cu2+¤ Cu - φ Zn2+¤ Zn =1.1V
Zn2+¤ Zn =1.1V
(2)电极电位产生
在金属与溶液两相界面上,由于带电质点的迁移形成了双电层,即溶液中的金属电极电位。


 双电层
双电层
有电位差-相界电位即电极电位
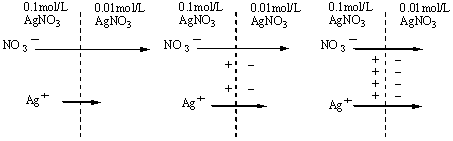
(3)液接电位
盐桥是用来消除两种不同组分或不同浓度溶液接触界面的液接电位的。
NO3-扩散快
(一)指示电极
电极电位与待测离子浓度有关。
1.金属基电极 是以金属为基体,基于电子转移反应的一类电极,按其组成及作用不同,分为:
(1)金属―金属离子电极
组成:Ag│Ag+电极
电极反应:Ag+ + e Ag
Ag
电极电位:φ = φ + 0.059lgαAg+
+ 0.059lgαAg+
=φ ' + 0.059lgCAg+
' + 0.059lgCAg+
(2)金属―金属难溶盐电极
2.银-氯化银电极
电极组成:Ag│AgCl(s)│Cl-
电极反应:AgCl + e Ag + Cl-
Ag + Cl-
电极电位:φ = φ AgCl/Ag - 0.059lgαCl-
AgCl/Ag - 0.059lgαCl-
3.惰性金属电极
金属本身不反应,起传递电子、导电的作用。
铂(Pt)电极
电极组成:Pt│Fe3+(C1),Fe2+(C2)
电极反应:Fe3++ e Fe2+
Fe2+
电极电位:φFe3+/ Fe2+ = φ Fe3+/ Fe2++ 0.059
Fe3+/ Fe2++ 0.059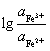
(二)参比电极
电位与待测离子浓度(活度)无关。
1.饱和甘汞电极
电极组成 Hg|Hg2Cl2(s)|KCl
电极反应:Hg2Cl2 + 2e 2Hg + 2Cl-
2Hg + 2Cl-
电极电位:φ = φ Hg2Cl2/Hg -0.059/2—lgα2Cl-
Hg2Cl2/Hg -0.059/2—lgα2Cl-
KCl浓度不同、温度不同、φ不同
2.银—氯化银电极
内参比溶液活度α一定,φ一定。可用作参比电极
第二节 直接电位法测定溶液的pH
目的:测定阴、阳离子浓度(活度)。
方法:两个电极:指示(和待测离子浓度有关)电极和参比电极。
一、 pH玻璃电极
(一)pH玻璃电极的构造
1.pH玻璃电极的构造
玻璃电极的电极电位=膜电位+内参比电极电极电位
(二)pH玻璃电极电位的产生
离子交换和离子扩散作用结果。
① 玻璃电极在水中浸泡时,水化层中Na+和水中H+交换,使水化层含H+。
② 玻璃电极置于待测溶液中,水化层和试液中αH+不同,H+。由高浓度向低浓度扩散,改变了膜外表面与待测溶液间两相界面原来的电荷分布,形成了双电层,产生电位差。此电位差称为外相界电位,用 外表示。同理,在膜内表面与内参比溶液间产生的电位差称内相界电位,用
外表示。同理,在膜内表面与内参比溶液间产生的电位差称内相界电位,用 内表示,
内表示,
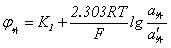
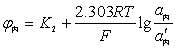
φ膜=φ外 - φ内
=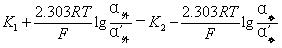
∵ K1=K2, 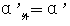 内
内
∴ 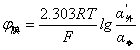
又∵ α定定值
∴ φ膜=K’+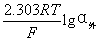
玻璃电极电极电位:
φ玻=φ内参 + φ膜
=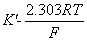 pH
pH
即: φ玻=K-0.059pH ( 25oC)
(三)pH玻璃电极的性能
1、电极斜率S
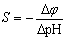 玻璃电极转换系数在25oC时,S=0.059V。电极使用过久时,S偏离理论值,电极不能用。
玻璃电极转换系数在25oC时,S=0.059V。电极使用过久时,S偏离理论值,电极不能用。
2、碱差与酸差
碱差(钠差):pH > 9时, 电极对Na+响应,实测αH+ >真实αH+;pH偏低,负误差(应使用锂玻璃电极)
酸差:是指当溶液pH<1时,实测pH>真实pH;正误差。
(pH 1-9范围内仅用普通玻璃电极)
3、不对称电位
φ膜=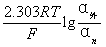
α外=α内时,φ膜理论上为0。
实际上,α外=α内时,φ膜≠0(1~3 mV)
主要是由于玻璃膜内外两表面的结构和性能不完全相同。玻璃电极使用之前在水中浸泡24h以上, 降低而且稳定。
降低而且稳定。
4、温度
二、 测定原理和方法
① 原电池组成
(一)Ag│AgCl(s),内充液│玻璃膜│试液┊┆ KCl(饱和),Hg2Cl2(s)│Hg(+)
简写:(一)玻璃电极│试液┊┆ SCE(+)
② 电池电动势:
E=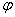 甘-
甘-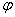 玻
玻
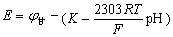 =
=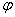 甘-(
甘-(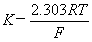 pH)
pH)
=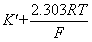 pH
pH
③ 两次测定法测pH值
pH标准缓冲液: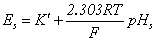
试 液: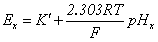
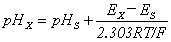 (25oC)
(25oC)
④ 玻璃电极使用注意事项
⑤ 复合pH电极
三、其他离子浓度的测定
1.标准曲线法
配制一系列Cs,测定Es,以测得的电动势Es与lgCs作图,绘制标准曲线。由测得的Ex与计算Cx
(需加入总离子强度调节缓冲剂,TISAB)
2. 两次测定法
第三节 电位滴定法
一、电位滴定法的基本原理
方法:记录滴定过程中电极电位(电池电动势)的变化。
定义:电位法是指示终点的方法。
特点:准确度高(与指示剂法比较),可以用于混浊液、有色液的滴定。
二、确定终点的方法
1.E-V曲线法 以加入滴定剂的体积V为横坐标,以与其对应的电位计读数E(电动势)为纵坐标,得到一条S型的E-V曲线。曲线的转折点(拐点)所对应的体积Ve即为滴定终点的体积。
 2.△E/△V- 曲线法 △E/△V表示滴定剂单位体积变化引起电动势的变化值,以△E/△V为纵坐标,以相邻两次加入滴定剂体积的算术平均值 为横坐标作图,得到一条峰状的△E/△V- 曲线,峰状曲线的最高点所对应的体积Ve即为滴定终点体积。
2.△E/△V- 曲线法 △E/△V表示滴定剂单位体积变化引起电动势的变化值,以△E/△V为纵坐标,以相邻两次加入滴定剂体积的算术平均值 为横坐标作图,得到一条峰状的△E/△V- 曲线,峰状曲线的最高点所对应的体积Ve即为滴定终点体积。
3.△2E/△V2 -V曲线法 △2E/△V2表示滴定剂单位体积改变引起的△E/△V的变化值,即△(△E/△V)/△V。以△2E/△V2为纵坐标,以V为横坐标作图,得到一条具有两个极值的△2E/△V2-V曲线,所以△2E/△V2 = 0时,所对应的体积Ve为滴定终点体积。
三、电位滴定仪
适合各种类型的电位滴定
第四节 永停滴定法
一、永停滴定法的基本原理
1、永停滴定法
又称双电流滴定法是根据滴定过程中电流的变化确定滴定终点的方法。
2、可逆的电对与不可逆的电对
可逆电对:如I2/I-电对、Ce4+/ Ce3+电对、Fe3+/Fe2+电对
不可逆电对:如S4O62-/S2O32-电对
定义、作用及对电流的影响
二、三种类型的滴定及其终点确定
(1)滴定剂为可逆电对,被测物为不可逆电对
碘液滴定硫代硫酸钠液:
|
溶液中离子及分子 |
电流 |
滴定前 |
S2O32- |
无 |
计量点前 |
S2O32- 、S4O62-、I- |
无 |
计量点时 |
I-、S4O62- |
无 |
计量点后 |
I2、I-、S4O62- |
有 |
(2)滴定剂为不可逆电对,被测物为可逆电对
如硫代硫酸钠液滴定碘液
|
溶液中离子及分子 |
电流 |
滴定前 |
I2、I- |
大 |
计量点前 |
I2、I-、Na2S4O6 |
变小 |
计量点时 |
I-、S4O62- |
无 |
计量点后 |
I-、S2O32-、S4O62- |
无 |
(3)滴定剂与被测物均为可逆电对
如Ce 4+液滴定Fe 2+液
|
溶液中离子及分子 |
电流 |
滴定前 |
Fe2+ |
无 |
半计量点前 |
Fe2+、 Fe3+、 Ce3+ |
有 |
半计量点时 |
C Fe2+= C Fe3+ |
最大 |
计量点前 |
|
下降 |
计量点时 |
Ce3+、 Fe3+ |
无 |
计量点后 |
Ce3+、Ce4+ |
有 |
 通知公告
通知公告

 友情链接:
友情链接: