第九章 紫外-可见分光光度法
第一节 光谱分析概述
掌握 紫外-可见分光光度法的基本原理
定性定量分析方法
熟悉 光谱分析概述
紫外-可见分光光度光度计
了解 紫外-可见吸收光谱在有机化合物结构
分析中的应用简介
一、电磁辐射与电磁波谱
(一)电磁辐射
1、光的波粒二象性
波动性:电磁辐射为正弦波(波长、频率、速度、振幅),传播速度c光波的波长λ和频率ν三者的关系:c =λ ·ν或λ= c /ν粒子性:光子的能量E与光波的频率或波长的关系是:E = h · ν = h c /λ当物质发射电磁辐射或者电磁辐射被物质吸收时,就会发生能量跃迁。
(二)电磁波谱
γ射线 → X 射线 → 紫外光→可见光→ 红外光→ 微波→无线电波
二、光学分析法的分类
定义:利用光电转换或其它电子器件测定“辐射与物质相互作用”之后的辐射强度等光学特性,进行物质的定性和定量分析的方法。
1、光谱法与非光谱法
光谱法是基于物质与辐射能作用时,分子发生能级跃迁而产生的发射、吸收或散射的波长强度进行分析的方法。
2、吸收光谱与发射光谱
吸收光谱又称吸收曲线,是以波长l(nm)为横坐标,吸光度A(或透光率T)为纵坐标所描绘的曲线。
发射光谱法:物质的原子、分子或离子在一定条件下,由低能态(基态)跃迁至高能态(激发态),再由高能态跃迁至低能态,同时产生电磁辐射,根据这种光谱而建立的分析方法称为发射光谱法。
原子光谱与分子光谱
三、紫外-可见吸收光谱法的特点
四、物质对光的选择性吸收
1、物质对光具有选择性吸收
2、不同波长的光具有不同的颜色
3、光的色散
如果让一束复合光通过棱镜或光栅,就能散射出多种颜色的光,这种现象称为光的色散
4、互补色光
第二节 紫外-可见分光光度法的基本原理
常用概念
1、吸收光谱
吸收光谱又称吸收曲线,是以波长l(nm)为横坐标,吸光度A(或透光率T)为纵坐标所描绘的曲线。
2、生色团
含有π®π* 和n®π*基团,如C=C、C=O、-N=N-、-NO2、-C=S等。
3、助色团
含有非键电子的饱和基团,如-OH、-NH2、-OR、-SH、-SR、-Cl、-Br、-I等。
4、红移和蓝移
红移是使吸收峰向长波长方向移动的现象。
蓝移是使吸收峰向短波长方向移动的现象
5、增色和减色效应
使吸收强度增加称增色效应或浓色效应;使吸收强度减弱称减色效应或淡色效应。
一、透光率和吸光度
1、透光率:溶液对光的透射程度T
2、吸光度:溶液对光的吸收程度A
A取值范围:0 ~ ∞,A越大,光被吸收的越多
二、吸收光谱曲线
以波长λ为横坐标,吸光度A为纵坐标所描绘的曲线
三、光的吸收定律
1、朗伯-比尔定律
公式推导:一束平行光通过一含有吸光物质物体:
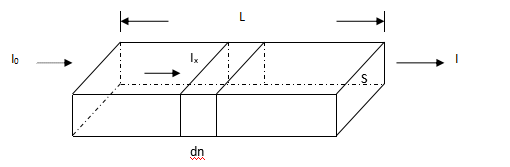
(S-物体的截面积,l-厚度,n-吸光质点数,光通过此物体后,由于一些光子被吸收,光强从I0降低至I。)
定义: 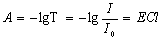
即: A=ECl (Lambert-Beer定律的数学表达式)
2、讨论
(1)Lambert-Beer定律适合于单色光
(2)由A =-lgT = ECl 得:T = 10-A = 10-ECl
(3)吸光度的重要性质:吸光度具有加合性。
四、吸光系数
1、摩尔吸光系数ε
是指在一定波长时,溶液浓度为1mol/L,厚度为1cm的吸光度。可以写为A=eCl
2、比吸光系数α
溶液浓度为1g/L,液层厚度为1cm时,在一定波长下测得的吸光度/
3、E为百分吸光系
物质的特性常数,是指在一定波长时,溶液浓度为1%(W/V),厚度为1cm时的吸光度(比吸光度值),用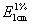 表示。注意浓度单位。
表示。注意浓度单位。
五、偏离光吸收定律的主要因素
Beer定律,吸光度A与浓度C之间的关系应该是一条通过原点的直线,即E为常数。
1、化学因素
溶液中溶质因浓度改变而有离解、缔合、与溶剂间的作用等原因而发生偏离Beer定律的现象。有时可用控制溶液条件减免。
例:(1)亚甲蓝在稀溶液中为单体,在浓溶液中为二聚体。
(2)重铬酸钾在水溶液离解成铬酸钾。
2、光学因素
(1)非单色光
仅用非单色光,由一定的谱带宽度,用S表示,越小光越纯,但仍是复合光。
设使用l1,l2 两种光,(E1和E2),两种光各以强度为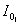 与
与 同时入射试样。则因:
同时入射试样。则因:
I = I0∙10-ECl
故此混合光的透光率为:
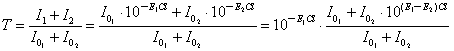

当E1=E2时,A=E1CL A~C 有线性关系
当E1≠E2时 A~C 非线性,偏离比尔定律
设l1是需要的光:当E1>E2时,测得的A值低,负误差;反之,产生正误差。且E1 与E2越接近,误差越小(使用最大吸收波长作为测定波长的优点之一)。
结论:单色光越纯越好;使用最大吸收波长作为测定波长可以减小测定误差。
(2)杂散光
仪器中常含有与所需波长相差较大的光,一般样品不吸收, 所以不干扰测定。
(3)非平行光
通过吸收池的非平行光影响l,不同仪器测定A值不同的主要原因。
(4)散射光和反射光
浑浊溶液产生散射和反射,不能用空白消除影响,共同仅I变小,但I0不变。A变大,正误差。
第三节 紫外-可见分光光度计
紫外-可见分光光度计的种类很多,质量差别悬殊,尽管各种光度计其构造各不相同,但其基本组成部分都是由下图几个部分组成。
一、紫外-可见分光光度计的主要部件
1、光源
光源的功能是提供能量激发被测物质分子,使之产生电子光谱谱带。
可见光区常用的光源是钨灯或碘钨灯,加热到白炽时发出波长约为320~1000nm的连续光谱。光强度与温度成正比,一般工作温度为2600~2870K(熔点3680K)。温度与电源电压有关,电压稳定,光强度稳定。
近紫外光区:使用氢灯或氘灯,产生180~375nm连续光谱。
2、单色器
色散元件的作用是将将复合光分解成单色光;它是分光光度计的心脏部分。
①入射狭缝:光源的光由此进入单色器;狭缝:将单色器的散射光切割成单色光。直接关系到仪器的分辨率。狭缝越小,光的单色性越好。狭缝分为入射狭缝和出射狭缝。
②准光装置:透镜或返射镜使入射光成为平行光束;
③色散元件:将复合光分解成单色光;棱镜或光栅;
棱镜:根据物质的折射率与光的波长有关。玻璃棱镜:可见, 石英棱镜:紫外、可见
光栅:在玻璃片或金属片上刻划均匀的线,1200条/mm, 根据光的衍射和干涉原理。
棱镜:玻璃350~3200 nm,石英185~4000 nm。
光栅:波长范围宽,色散均匀,分辨性能好,使用方便。
棱镜单器由棱镜、透镜和狭缝组成。单色的纯度决定于棱镜的色散率和出射狭缝的宽度。
玻璃棱镜对400~1000nm波长的光色散较大,适用于可见光分光光度计。
光栅是利用光的衍射和干涉原理而进行分光作用。具有色散均匀、工作波长范围宽、分辨率高等特点,一般用于中高档仪器中。
④聚焦装置:透镜或凹面反射镜,将分光后所得单色光聚焦至出射狭缝;
⑤出射狭缝。
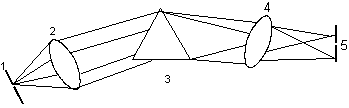
1.入射狭缝 2.准直透镜 3.棱镜 4.聚焦棱镜 5.出射狭缝
3、吸收池(比色皿):用于盛装试液和参比溶液。玻璃:可见, 石英:紫外、可见。
规格有0.5、1.0、2.0、5.0cm 等。
4、检测器:是把透过吸收池后的透射光强度转换成电讯号的装置。故又称为光电转换器,(光电管、光电倍增管)。
5、显示器:将放大的电信号以透光率T或吸光度A的方式显示或记录下来(检流计、微安表、数字显示记录仪等)。将监测器输出的信号放大并显示出来的装置。
二、紫外-可见分光光度计的光学性能
三、紫外-可见分光光度计的仪器类型
(一)可见分光光度计
(二)紫外-可见分光光度计
1.单光束分光光度计
2.双光束分光光度计
3.双波长分光光度计
第四节分析条件的选择
一、仪器测量条件的选择
(一)测量波长的选择
选择最大吸收波长作为入射光。
(二)读书范围的选择
读数范围应控制在吸光度为0.2~0.7、 透光率为20%~65%之间。
二、显色反应条件的选择:
(一)对显色剂及显色反应的要求
(二)显色反应的条件
三、参比溶液的选择
(一)溶剂参比溶液
(二)试剂参比溶液
(三)试样参比溶液
(四)平行操作参比溶液
第五节 定性定量分析方法
一、定性分析方法
(一)对比吸收光谱的一致性
对照品和样品同时绘制吸收曲线进行对比。
(二)对比吸收光谱特征数据
lmax , lmin ,ε 等
(三)
对比吸光度(或吸光系数)的比值
二、杂质检查
1、组分在某波长处无吸收
杂质有吸收:如: 乙醇中含苯,在λ=256 nm处测A值检查苯
组分有吸收,杂质无吸收:A↓,E↓。
2、杂质限量检查
如:肾上腺素中的肾上腺酮(杂质)的检查,在λ=310nm处杂质有吸收,可测得肾上腺酮的限量(≤0.06%)。
二、定量分析方法
(一)单组分溶液的定量方法
注意使用溶剂的截止波长。
1、标准曲线法
配制稀系列对照品溶液C1~C5,测定吸光度A1~A5,绘制标准曲线。由标准曲线计算样品浓度Cx。
2、标准溶液对比法对照法
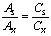 由关系式Cx:
由关系式Cx:
3、吸光系数法
已知E或e,求C(主要浓度的单位)。
(二)二元组分溶液的定量方法
1.解联立方程组法
2.等吸收波长消去法
3.差示分光光度法
第六节 紫外-可见吸收光谱在有机化合物结构分析中的应用简介
一、有机化合物的紫外-可见吸收光谱
有机化合物的紫外-可见吸收光谱主要是由分子中价电子的能级跃迁而产生的。电子的能级跃迁有4个基本类型。
二、根据紫外-可见吸收光谱推断官能团
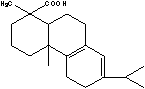
(一)结构异构体的推断
反式异构体最大吸收波长λmax和摩尔吸收系数εmax都大于顺式异构体。例:1,2-二苯乙烯的反式异构体的光谱特征为λmax=295.5nm,εmax=29 000L/(mol·cm);1,2-二苯乙烯的顺式异构体的光谱特征为λmax=280nm,εmax=10 500L/(mol·cm)。
(Ⅰ) (Ⅱ)
(2)顺反异构体的推断
反式异构体最大吸收波长λmax和摩尔吸收系数εmax都大于顺式异构体。例:1,2-二苯乙烯的反式异构体的光谱特征为λmax=295.5nm,εmax=29 000L/(mol·cm);1,2-二苯乙烯的顺式异构体的光谱特征为λmax=280nm,εmax=10 500L/(mol·cm)。
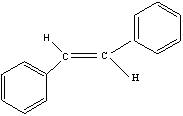

反式1,2-二苯乙烯 顺式1,2-二苯乙烯
(3)互变异构体的推断
分子中存在共轭体系时,其λmax、εmax一般要大于非共轭体系异构体的光谱特征。
例:乙酰乙酸乙酯有酮式和烯醇式两个互变异构体,酮式结构没有共轭双键,其光谱特征为:λmax=204nm,εmax=16L/(mol·cm) ;烯醇式异构体有共轭双键,其光谱特征为λmax=245nm,εmax=1.8×104L/(mol·cm)。
 通知公告
通知公告

 友情链接:
友情链接: