一、名词解释(每小题4分,共20分)
1. 系统误差
2. 滴定度
3. 称量形式
4. 红移
5. 薄层色谱法
二、填空题(每空1分,共20分)
1. 分析化学是研究物质的组成、 、 和 等化学信息的分析方法及理论的一门科学。
2. 不符合基准物质条件的试剂,可用 法来配制其标准溶液。
3. 一张红外吸收光谱可由吸收峰的 及吸收峰的 来描述。
4. 系统误差可分为 、 、 、 。
5.在EDTA七种形式中,只有_______才能与金属离子直接生成稳定的配合物。
6. 影响沉淀纯度的主要因素是 和 。在晶型沉淀的沉淀过程中,若加入沉淀剂过快,除了造成沉淀剂局部过浓影响晶型外,还会发生
现象,使分析结果 。
7. 碘在水中的溶解度小,挥发性强,所以配制碘标准溶液时,将一定量的碘溶于___ ____溶液。
8.可见光的波长范围为 ,近紫外分光的波长范围为 。可见分光光度法中选用__________吸收池;紫外分光光度法中选用__________吸收池。
三、选择题(每小题2分,共30分)
1. 在非水酸碱滴定中,常使用高氯酸的冰醋酸溶液。为了除去水分,需加入适量的( )
A.醋酐 B.无水CaCl2
C.醋酸汞 D.乙醚
2. 已知CO2的结构式为O=C=O,请推测其红外光谱中,基本振动数为( )
A.4个 B.3个 C.2个 D.5个
3. 在不加样品的情况下,用测定样品同样的方法、步骤,对空白样品进行定量分析,称之为( )
A、对照试验 B、平行试验 C、空白试验 D、预试验
4. 朗伯-比耳定律适用于()
A.非单色光 B.介质的不均匀
C. 单色光 D.溶液浓度较高
5. 在半微量分析中对固体物质称量范围的要求是:( )
A.0.01~0.1g B.0.1~1g
C.0.001~0.01g D.0.00001~0.0001g
6. 工作要求测定结果的误差应( )。
A、愈小愈好 B、等于零
C、没有要求 D、在允许误差范围内
7. EDTA与金属离子形成配合物时,其配位比为( )。
A、1:1 B、1:2 C、2:1 D、1:6
8.不能用莫尔法测定的离子是( )
A、Cl- B、Br- C、Ag+ D、SCN-和I-
9. 下列各项叙述中不是滴定分析对化学反应要求的是( )。
A. 反应必须有确定的化学计量关系 B. 反应必须完全
C. 反应速度要快 D. 反应物的摩尔质量要大
10. 根据试样用量的多少,试样用量在 0.1g 以上的属于: ( )
A、超微量分析 B、半微量分析
C、微量分析 D、常量分析
11. 在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接滴定其中的M而N不干扰,要求( )
A、pH=pK’MY B、pK’MY < pK’MIn
C 、lgK’MY –lgK’NY≥5 D、MIn与HIn颜色应有明显的区别
12. 下列叙述中,哪个不是重量分析对称量形式的要求( )。
A. 称量形式必须有确定的化学组成 B. 称量形式必须稳定
C. 称量形式的颗粒要大 D. 称量形式的摩尔质量要大
13. 下列哪种方法属于氧化还原滴定法
A KMnO4滴定法 B EDTA滴定法
C 银量法 D 盐溶液的标定
14.在含有AgCl沉淀的溶液中,加入氨水,将使AgCl沉淀的溶解度增大,这种效应属于( )
A、同离子效应 B、盐效应 C、酸效应 D、配位效应
15.KMnO4法应用( )
A、自身指示剂 B、外指示剂 C、金属指示剂 D、吸附指示剂
四、简答、计算题(每小题10分,共30分)
1. 简述红外光谱与紫外-可见光谱的区别。(10分)
2. 用0.10mol/L的NaOH溶液标定HCl溶液,取20.00mlHCl溶液置于锥形瓶中,加入酚酞指示剂2滴,滴定终点时消耗NaOH滴定液21.50ml,求HCl溶液的浓度?(10分)
3. 称取含铝试样0.5300g,溶解后定溶为100.0mL的溶液。精密吸取20.00ml上述溶液于锥形瓶中,准确加入EDTA(0.05012mol·L-1)标准溶液20.00ml,控制条件使Al3+与EDTA反应完全,然后用的ZnSO4(0.05035mol·L-1)标准溶液滴定剩余的EDTA,消耗ZnSO4标准溶液15.20ml,计算试样中Al2O3的含量。 (已知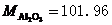 )(10分)
)(10分)
参考答案
一、名词解释(每小题4分,共20分)
1.系统误差:由某种确定的原因所引起的误差,一般有固定的方向(正负)和大小,重复测定时重复出现。
2. 滴定度:每1ml某摩尔浓度的滴定液所相当的被测药物的质量(g/ml)。
3. 称量形式:沉淀形式经处理后供最后称量的化学组成。
4. 由于结构或实验条件的变化,使吸收峰向长波长方向移动的现象称为红移。
5. 薄层色谱法:将固定相均匀的铺在光洁的玻璃板上以形成薄层,然后在薄层上进行分离并进行定性与定量分析的方法。
二、填空题(每空1分,共20分)
1. 组成;含量;结构等2. 间接法3. 位置;强度
4. 仪器误差;方法误差;试剂误差;操作误差5. [Y4-]。
6. 共沉淀;后沉淀;吸留;偏高7. 碘化钾。8. 400nm-760nm; 200nm-400nm; 玻璃;石英
三、选择题(每小题2分,共30分)
1.A2.D3.C4.C5.D6.D7.A8.D9.D10.D11.C12.C13.A14.D15.A
四、简答、计算题(每小题10分,共30分)
1.(10分)
答:首先是吸收原理不一样,红外光谱产生的原因是分子振动,吸收的能级较低,吸收光的范围在红外区.而紫外光谱产生的原因是因为分子内电子跃迁.能级稍高,吸收光的范围在紫外可见区.;然后是仪器,光谱表达不一样;还有是用途不一样,红外用于判断化合物的结构,官能团等,紫外用于判断化合物的共轭情况,以及定量分析.
2.(10分)
解:VHCl=20.00ml VNaOH=21.50ml CNaOH=0.10 mol/l n NaOH=VNaOH ×CNaOH
CHCl= n NaOH/ VHCl=(21.50 ×0.10)/20.00=0.1075 mol/l
3.(10分)
解:总的EDTA的物质的量:cEDTAVEDTA=0.05012×20.00(moL)
剩余的EDTA的物质的量:c ZnSO4V ZnSO4=0.05035×15.20(moL)
消耗掉的EDTA的物质的量:cEDTAVEDTA -c ZnSO4V ZnSO4=0.05012×20.00-0.05035×15.20(moL)
试样中Al2O3的含量: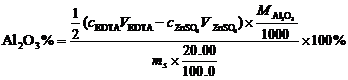
 通知公告
通知公告

 友情链接:
友情链接: