第四章 酸碱滴定法
第一节 酸碱指示剂
掌握:酸碱指示剂的选择原则和常用酸碱指示剂的使用
强酸与强碱相互滴定
一元弱酸(碱)滴定的基本原理
酸碱滴定液的配制与标定等
熟悉:酸碱指示剂的变色原理
变色范围和多元酸(碱)的滴定条件及指示剂的选择
返滴定法和测定混合碱含量的原理
了解:混合指示剂作用原理
非水溶剂的分类
非水酸碱滴定法和酸碱间接滴定法的应用
一、 酸碱指示剂的变色原理和变色范围
(一)酸碱指示剂的变色原理
 甲基橙 酸式 - 红色 酚酞 酸式 - 无色
甲基橙 酸式 - 红色 酚酞 酸式 - 无色
碱式 - 黄色 碱式 - 红色
(二)酸碱指示剂的变色范围
HIn = In- + H+ Kin = [In-][H+] / [HIn] Þ [In-] / [HIn] = Kin / [H+]
(酸式色) (碱式色)
可见,溶液的颜色由指示剂常数Kin和溶液的pH值决定。
[In-] / [HIn] ³ 10 …… 显碱式色
[In-] / [HIn] £ 1/10 …… 显酸式色
1/10 < [In-] / [HIn] < 10 即Kin / 10 < [H+] < 10Kin …… 显混合色
pH = pKin ± 1(明显看到指示剂由酸式色变为碱式) …… 指示剂的变色范围
[In-] = [HIn] 即 [H+] = Kin , pH = pKin …… 理论变色点(显中间色)
理论上,指示剂的变色范围是2个pH,但实际上,指示剂的变色范围是人的目视确定的,由于人眼对不同颜色的敏感程度不同,指示剂实际变色范围的pH幅度一般在1~2个pH单位。例如,甲基红的理论变色范围为4.1~6.1,而实际变色范围为4.4~6.2;甲基橙的理论变色范围为2.4~4.4,而实际变色范围为3.1~4.4。
在实际滴定中,并不需要指示剂从酸式色完全变为碱式色,而只要看到明显的色变就可以了。通常在指示剂的变色范围内有一点颜色变化特别明显,这一点就是实际的滴定终点,称为指示剂的滴定指数,以PT表示。但在观察这一点时,还会有0.3pH的出入,DpH = 0.3常常作为目视滴定分辨终点的极限。
酸碱滴定中,化学计量点前后应有一较大的pH变化,才能使指示剂有颜色突变,据此选择合适的指示剂以便获得准确的分析结果。
结论:指示剂的变色范围越窄越好。
二、 影响酸碱指示剂变色范围的因素
1. 指示剂的用量
 双色指示剂:溶液颜色决定于[In-] / [HIn] = Kin / [H+],与CHIn无关,但指示剂量多使终点变色不敏锐。
双色指示剂:溶液颜色决定于[In-] / [HIn] = Kin / [H+],与CHIn无关,但指示剂量多使终点变色不敏锐。
单色指示剂:溶液颜色仅决定于[In-]或[HIn],即d × CHIn,由于人眼观察到的[In-]或[HIn]为一确定值,CHIn大小影响d,即影响pH,故指示剂的用量多少影响变色范围。
 2.温度
2.温度
通过影响Kin影响变色范围。
3. 离子强度及其他
三、混合指示剂
利用颜色互补原理使终点颜色变化敏锐。混合指示剂的变色范围窄。例如甲基红-溴甲酚绿混合指示剂,在溶液由酸性至碱性转变时,溶液颜色由酒红®灰®绿,常用于以为Na2CO3基准物质标定HCl标准溶液的浓度。
第二节 酸碱滴定类型与指示剂的选择
估计被测物质能否被准确滴定,滴定过程中溶液的pH变化情况,以及如何选择合适的指示剂来确定滴定终点。
一、强酸与强碱滴定及指示剂的选择
1. 强碱滴定强酸
H+ + OH- = H2O 滴定反应常数 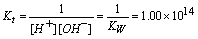
例:以NaOH (Cb= 0.1000mol/L) 滴定HCl (Va=20.00ml,Ca= 0.1000mol/L)
1) Vb= 0 [H+] = 0.1000 pH = 1.00
2) Vb< Va [H+] = 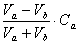
#化学计量点前0.1% Vb= 19.98 [H+] = 5.00´10-5 pH = 4.30
3) Vb= Va [H+] = [OH-] = 10-7 pH = 7.00
4) Vb > Va [OH-] = 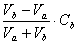
化学计量点后0.1% Vb= 20.02 [OH-] = 5.00´10-5 pH = 14-pOH = 9.70
滴定突跃范围:4.30 ~ 9.70
DpH=5.40 [H+] ¯ 25万倍
指示剂:酚 酞 8.0 ~ 10.0
甲基红 4.4 ~ 6.2
甲基橙 橙色 pH»4 -0.2%
黄色 pH»4.4 -0.1%
选择指示剂的依据:指示剂变色点的pH处于滴定突跃范围内。 或指示剂的变色范围部分或全部在滴定突跃范围内(部分有时误差较大,全部可保证终点误差<0.1%)。
2. 强酸滴定强碱
滴定突跃范围:10.70 ~ 3.30 (1mol/L)
9.70 ~ 4.30 (0.1mol/L) 甲基橙 滴至橙色 pH»4 -0.2%
8.70 ~ 5.30 (0.01mol/L) 可用甲基红、酚酞,不能用甲基橙
Ca Þ 突跃范围
二、强碱(酸)滴定弱酸(碱)及指示剂的选择
1. 强碱滴定弱酸
HA + OH- = H2O + A- 滴定反应常数 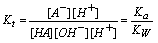
例:以NaOH (Cb= 0.1000mol/L) 滴定HAc (Va=20.00ml,Ca= 0.1000mol/L)
1) Vb= 0 [H+] = 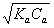 = 1.36´10-3 pH = 2.88
= 1.36´10-3 pH = 2.88
2) Vb< Va pH = pKa+ lg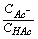
其中 [Ac-] = 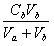 [HAc] =
[HAc] = 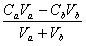
即 pH = pKa + lg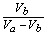
化学计量点前0.1% Vb= 19.98 pH = 7.75
3) Vb= Va [OH-] = 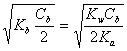 pH = 14-pOH=8.73
pH = 14-pOH=8.73
4) Vb > Va
因溶液为碱性,且(C2-C1)>20[HAc],[OH-] » C2 - C1 = 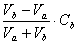
化学计量点后0.1% Vb= 20.02 [OH-] = 5.00´10-5 pH = 14-pOH = 9.70
滴定突跃范围:7.75 ~ 9.70
指示剂:酚酞、百里酚酞
2. 强酸滴定弱碱
BOH + H+ = H2O + B+ 滴定反应常数 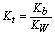
例:以HCl (Cb= 0.1000mol/L) 滴定NH3×H2O (Va=20.00ml,Ca= 0.1000mol/L)
滴定突跃范围:6.24~4.30 (0.1% 准确度)
化学计量点:pH = 5.28
指示剂:甲基橙(滴至橙色 pH»4 0.2%)、甲基红
结论:① 滴定突跃范围的确定和适宜指示剂的选择取决于对分析结果准确度的要求。
② Ka(Kb),Ca(Cb) Þ 滴定突跃范围
讨论:Ka(Kb)和Ca(Cb)应该多大,才能以强碱(酸)直接滴定弱酸(碱)?
以NaOH滴定HA为例,欲达到0.2%准确度的要求
化学计量点前0.2% pH = pKa +lg (Cb / Ca) = pKa + lg (99.8% / 0.2%) = -lgKa + 2.7
化学计量点后0.2% [OH-] = Ca ´ 0.2% / 2 = Ca / 1000
pOH = 3 - lg Ca pH = 14 - pOH = 11+ lg Ca
一般,滴定突跃 DpH ³ 0.3,人眼可以辨别出指示剂的颜色变化(尽管混合指示剂的变色范围窄,但也具有一定的变色范围,若滴定突跃太小,人眼则难以辨别指示剂的颜色变化。一般以0.3pH为人眼借助指示剂判断终点的极限)
DpH = 8.3 + lg CaKa ³ 0.3 lg CaKa ³ -8 CaKa ³ 10-8
其它说法:借助指示剂观察终点有0.3pH单位的不确定性,为使终点与化学计量点 相差 ± 0.3pH,即滴定突跃为0.6pH,在浓度不太稀的情况下,要求CaKa ³ 10-8,这时终点误差不大于0.2%。
直接滴定一元弱酸(碱)的可行性判断:
(1)CaKa ³ 10-8 或CbKb ³ 10-8
(2)若CaKa < 10-8 或CbKb < 10-8,不能用指示剂准确指示终点,但可以用仪器检测终点或在非水溶液中进行滴定。
(3)凡不能用直接法滴定的物质,也不能用返滴定法滴定。
三、强碱(酸)滴定多元弱酸(碱)及指示剂的选择
用强碱(酸)滴定多元酸(碱)时,化学计量点附近的pH突跃大小与相邻两级离解常数的比值有关。要保证滴定误差为1%,该比值必须大于104(证明略)。
多元酸(碱)能否被准确分步滴定的判断原则(以多元酸为例):
① CKa1 ³ 10-8,且Ka1 / Ka2 ³ 104,第一化学计量点附近出现突跃;
CKa2 ³ 10-8,且Ka2 / Ka3 ³ 104,第二化学计量点附近出现突跃;
② CKa1 ³ 10-8,CKa2 < 10-8,且Ka1 / Ka2 ³ 104,酸第一步离解的H+被滴定,第二步离解的H+不能被准确滴定,只能形成一个突跃。
③ CKa1 ³ 10-8,CKa2 ³ 10-8,但Ka1 / Ka2 < 104,两步离解的H+被同时滴定,不能分步滴定,只能形成一个突跃。
混合弱酸(碱)的滴定与多元酸(碱)相似。
1. 多元酸的滴定
例:以NaOH (Cb= 0.1000mol/L) 滴定H3PO4 (Va=20.00ml,Ca= 0.1000mol/L)
H3PO4 = H+ + H2PO4- pKa1 = 2.12
H2PO4-= H+ + HPO42- pKa2 = 7.21
HPO42-= H+ + PO43- pKa3 = 12.66
满足 CKa1 ³ 10-8,且Ka1 / Ka2 ³ 104,第一化学计量点附近出现突跃;
CKa2 ≈ 10-8,且Ka2 / Ka3 ³ 104,第二化学计量点附近出现突跃;
CKa3 < 10-8,无法确定第三化学计量点,故不能直接滴定。
用最简式计算,得
第一化学计量点:[H+] = 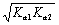 pH = 4.66 (产物NaH2PO4)
pH = 4.66 (产物NaH2PO4)
第二化学计量点:[H+] = 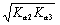 pH = 9.94 (产物Na2HPO4)
pH = 9.94 (产物Na2HPO4)
实际上,第一化学计量点pH = 4.70时,d0 =d2= 0.003,d1 = 0.994,说明当0.3%的H3PO4尚未被中和时,已经有0.3%的H2PO4-被进一步中和成HPO42-,由于多元酸的分步滴定准确度要求不太高,故H3PO4通常被认为可用强碱分步滴定。
例:H2C2O4 Ka1= 5.6´10-2 Ka2= 5.4´10-5 因Ka1 / Ka2 » 103
不能准确进行分步滴定,但CKa2 ³ 10-8,可同时被滴定,有一个突跃。
2. 多元碱的滴定
例:以HCl (Ca= 0.1000mol/L) 滴定Na2CO3 (Vb=20.00ml,Cb= 0.1000mol/L)
CO32-+ H+ = HCO3- pKb1 = 3.75
HCO3-+ H+ = H2CO3 pKb2 = 7.62
满足 CKb1 ³ 10-8,且Kb1 / Kb2 »104,第一化学计量点附近出现一个不明显的突跃;由于Kb1 较小,第二化学计量点附近突跃也较小。
第一化学计量点(产物NaHCO3):
[H+] = 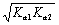 pH=8.31 指示剂:酚酞
pH=8.31 指示剂:酚酞
第二化学计量点(产物CO2):
[H+] =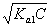 pH = 3.89 指示剂:甲基橙、甲基红-溴甲酚绿
pH = 3.89 指示剂:甲基橙、甲基红-溴甲酚绿
其中,C = 0.04mol/L 近终点煮沸,以除去CO2,冷却后再滴定,以防终点提前出现。
第三节 酸碱滴定液的配制与标定和酸碱滴定法应用
一、酸滴定液
HCl标准溶液 ¾¾ 常用硼砂(Na2B4O7 ×10H2O)和无水碳酸钠标定
二、碱滴定液
NaOH标准溶液 ¾¾ 采用浓碱法配制,常用邻苯二甲酸氢钾或草酸标定
三、酸碱滴定法的应用
1. 直接滴定法
适用物质:CaKa ³ 10-8 的酸性物质、CbKb ³ 10-8 的碱性物质
例:混合碱的分析 (双指示剂法)
1) NaOH + Na2CO3
¯ HCl V1 酚酞 NaOH:V1- V2
NaCl + NaHCO3
¯ HCl V2 甲基橙 Na2CO3:2V2
NaCl + CO2 + H2O
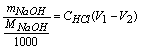 NaOH% =
NaOH% = 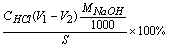
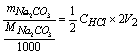 Na2CO3% =
Na2CO3% = 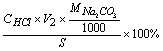
2) Na2CO3 + NaHCO3
¯ HCl V1 酚酞 Na2CO3:2V1
NaCl + NaHCO3
¯ HCl V2 甲基橙 NaHCO3:V2- V1
NaCl + CO2 + H2O
例:判断样品组成
1) 连续滴定 V1 (酚酞) ® V2 (甲基橙)
V1 ¹ 0 V2 = 0 NaOH
V1= 0 V2 ¹ 0 NaHCO3
V1= V2 Na2CO3
V1 > V2 NaOH + Na2CO3
V1 < V2 NaHCO3 + Na2CO3
注:NaHCO3 与 NaOH 不能共存
2) 分别滴定 V1 (酚酞) V2 (甲基橙)
V1= V2 NaOH
V1= 0 V2 ¹ 0 NaHCO3
2V1= V2 Na2CO3
2V1> V2 V2 > V1 NaOH + Na2CO3
2V1< V2 V2 > V1 NaHCO3 + Na2CO3
2. 间接滴定法
第四节 非水溶液酸碱滴定法
在非水溶剂中进行的滴定分析方法称为非水滴定法。该法可用于酸碱滴定、氧化还原滴定、配位滴定及沉淀滴定等,在药物分析中,以非水酸碱滴定法应用最为广泛,故本章重点讨论非水酸碱滴定法。
适用:① 难溶于水的有机物
② 在水中不能直接被滴定的弱酸(CaKa<10-8)或弱碱(CbKb<10-8)
③ 在水中不能被分步滴定的强酸或强碱
特点:扩大滴定分析的应用范围。
一、基本原理
1.溶剂的分类
根据酸碱的质子理论分类:
 酸性溶剂 如:冰醋酸、丙酸等
酸性溶剂 如:冰醋酸、丙酸等
质子溶剂 碱性溶剂 如:乙二胺、乙醇胺等
 两性溶剂 如:醇类等
两性溶剂 如:醇类等
 偶极亲质子溶剂 如:酰胺类、酮类等
偶极亲质子溶剂 如:酰胺类、酮类等
无质子溶剂 惰性溶剂 如:氯仿、苯等
2.溶剂的性质
(1)溶剂的酸碱性
现以HA代表酸,B代表碱,根据质子理论有下列平衡存在:
HA = H+ + A- 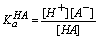
B + H+ = BH+ 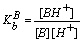
若酸碱溶于质子溶剂SH中,则发生下列质子转移反应,
HA + SH = SH2+ + A- 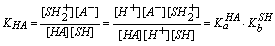
B + SH = S- + BH+ 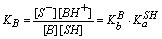
其中,KHA、KB分别为酸HA、碱B的表观离解常数。
可见,酸(碱)在溶剂中的表观酸(碱)强度决定于酸(碱)的固有酸(碱)度和溶剂的碱(酸)度。
结论:酸、碱的强度不仅与酸、碱本身授受质子的能力有关,而且与溶剂授受质子的能力有关。弱酸溶于碱性溶剂中可以增强其酸性,弱碱溶于酸性溶剂中可以增强其碱性。
(2)溶剂的离解性
溶剂的质子自递常数
SH = H+ + S- 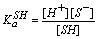 固有酸度常数
固有酸度常数
SH + H+ = SH2+ 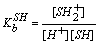 固有碱度常数
固有碱度常数
SH + SH = SH2+ + S- 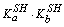 [SH] 2 =[SH2+][S-] = KS 溶剂的质子自递常数
[SH] 2 =[SH2+][S-] = KS 溶剂的质子自递常数
KS对滴定突跃范围的影响:
溶剂 H2O(pKS=14) C2H5OH(pKS=19.1)
碱 NaOH C2H5ONa
¯ ¯ ¯
酸 H3O+ C2H5OH2+
化学计量点前 pH=4 pH*=4
化学计量点后 pH=14-4=10 pH*=19.1-4=15.1
DpH 6 11.1
结论:KS ¯ Þ 突跃范围 , 终点敏锐。
例如,在甲基异丁酮介质中(pKS >30),用氢氧化四丁基铵作为滴定剂,可分别滴定HClO4和H2SO4。
(3)溶剂的均化效应和区分效应
均化效应:一种溶剂将不同强度的酸(碱)均化到溶剂合质子SH2+(溶剂阴离子S-)的强度水平。例如:
HClO4 + H2O = H3O+ + ClO4-
HCl + H2O = H3O+ + Cl-
水是HClO4和HCl的均化性溶剂。
区分效应:能区分酸碱强弱的效应。例如:
HClO4 + HAc =H2Ac+ + ClO4- Ka=1.3´10-5
HCl + H2O = H2Ac+ + Cl- Ka=2.8´10-9
醋酸是HClO4和HCl的区分性溶剂。

 结论: 均化 共存酸 区分
结论: 均化 共存酸 区分

 碱性溶剂 酸性溶剂
碱性溶剂 酸性溶剂
区分 共存碱 均化
可见,在水溶液中不能直接滴定的弱酸或弱碱,通过选择适当的溶剂使其强度增强即可完成滴定,例如,滴定弱碱应选择酸性溶剂,常用冰醋酸的高氯酸溶液。测定强度不同的酸或碱,宜选用酸碱性皆弱的溶剂,如惰性溶剂及pKS大的溶剂,例如,甲基异丁酮对高氯酸、盐酸、水杨酸、醋酸和苯酚有良好的区分效应。
3.溶剂的选择
选择溶剂首先要考虑的是溶剂的酸碱性。
二、碱的滴定
非水酸碱滴定中,滴定碱的标准溶液是:高氯酸的冰醋酸溶液。常用的溶剂是冰醋酸 。
三、酸的滴定
滴定弱酸常用的溶剂是苯-甲醇混合溶剂
常用标准溶液是甲醇钠的苯-甲醇溶液
 通知公告
通知公告

 友情链接:
友情链接: